Received: июнь 2016
Fluorine Notes, 2016, 107, 3-4
Синтез и свойства полифторированных олигомеров ε–аминокапроновой кислоты
А. В. Мирошниченко, А. И. Рахимов, Н. А. Рахимова
Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация: Олигомеры ε–аминокапроновой кислоты общей формулы H-[HN-(CH2)5-C(O)]m-OH (m = 60-80) были выделены из отходов производства поликапроамида и модифицированы реакциями с полифторированными спиртами H(CF2CF2)nCH2OH и полифторалкилхлорсульфитами H(CF2CF2)nCH2OS(O)Cl, n = 1, 2. Исследование полученных продуктов (растворимость, ИК-спектры, элементный анализ) показало, что основным направлением реакции олигомеров с полифторированными спиртами является N-полифторалкилирование, а с полифторалкилхлорсульфитами О- полифторалкилирование. Получены полифторалкилированные олигомеры с содержанием фтора 0.29-6.67% и молекулярной массой от 4600 до 9500.
Ключевые слова: Олигомеры ε–аминокапроновой кислоты, полифторалкилхлорсульфиты, полифторированные спирты, полифторалкилирование, полифторалкоголиз.
Известно, что олигоамиды, также как и полиамиды, обладают рядом ценных свойств, таких как высокие адгезионные свойства, гидрофобность, нетоксичность, маслобензостойкость, износостойкость полимерных изделий и покрытий. Кроме того, наличие в структуре олигомеров реакционноспособных концевых групп создает возможность их модификации, что позволяет придавать им новые полезные свойства. Введение полифторалкильных групп, как было показано [1, 2], увеличивает гидрофобность олигомерных покрытий и придает им пониженную способность к воспламенению. Добавка в поликапроамид низкомолекулярных полифторалкилированных олигомеров значительно облегчает его переработку и увеличивает износостойкость [3].
Ранее полифторалкиловые эфиры олигомеров ε–аминокапроновой кислоты были получены реакцией полифторированных спиртов с ε–капролактамом в условиях катализа триэтиламином и амидами кислот [2]. Оценка их медико-биологической активности методом вычислительного прогноза показала высокую антивирусную активность. Высокая антивирусная активность олигомеров ε–аминокапроновой кислоты была подтверждена экспериментально в Институте гриппа РАМН (г. Санкт-Петербург, профессор Киселев О. И.) [4].
В связи с этим нам представлялось необходимым изучить полифторалкоголиз и полифторалкилирование фракции олигомеров ε–аминокапроновой кислоты, растворимой в воде, ввиду промышленной доступности этих олигомеров.
Перекристаллизацией отходов из воды была выделена фракция олигомеров общей формулы H-[HN-(CH2)5-C(O)]m-OH. По количеству концевых групп было определено, что m = 60-80. Далее олигомер модифицировали полифторированными спиртами H(CF2CF2)nCH2OH и полифторалкилхлорсульфитами H(CF2CF2)nCH2OS(O)Cl, n = 1, 2.
Известно, что полифторалкилхлорсульфиты – высокореакционноспособные соединения, мягкие реагенты для полифторалкилирования по НО-группе спиртов, фенолов, карбоновых кислот [5-8].
Реакция полифторалкилхлорсульфитов с олигомером в присутствии триэтиламина идет в мягких условиях, преимущественно по карбоксильной группе (также как для карбоновых кислот) и приводит к образованию водорастворимых олигомеров Iа и Iб. Образование шестичленного полярного переходного состояния способствует нуклеофильному замещению по α-метиленовой группе полифторалкилхлорсульфитов с участием карбоксильной группы:
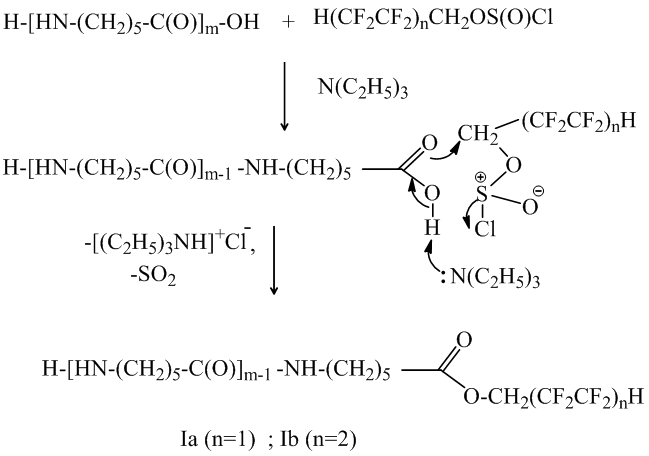
Далее реакция идёт с образованием водонерастворимых N, O-ди(полифторалкил) производных олигомеров IIа и IIб:
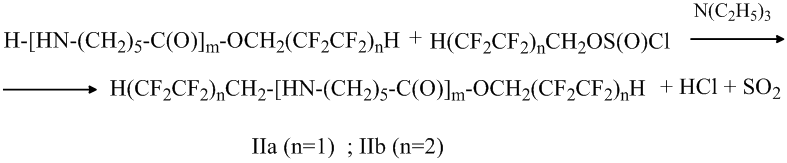
Реакция исходных олигокапроамидов со фторированными спиртами, по-видимому, протекает следующим образом:
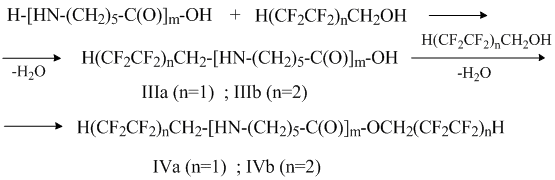
Очевидно, механизм N- и О- полифторалкилирования олигомера полифторированным спиртом отличается от механизма реакции с полифторалкилхлорсульфитом. Кислотный характер спирта и низкая электронная плотность на атоме кислорода НО-группы затрудняет этерификацию карбонильной группы олигомера и взаимодействие может идти с разрывом амидной связи (поэтому уменьшается молекулярная масса олигомеров III и IV), а наличие электрофильного центра на атоме углерода СН2-группы способствует атаке неподеленной парой электронов атома азота концевой NH2-группы молекулы олигомера этого центра. На это указывает тот факт, что основным продуктом реакции полифторированного спирта с олигомером является продукт моно-N-полифторалкилирования – (IIIа, IIIб). Причем, стабилизации переходной структуры способствует образование внутримолекулярной водородной связи –F ∙∙∙ H- :
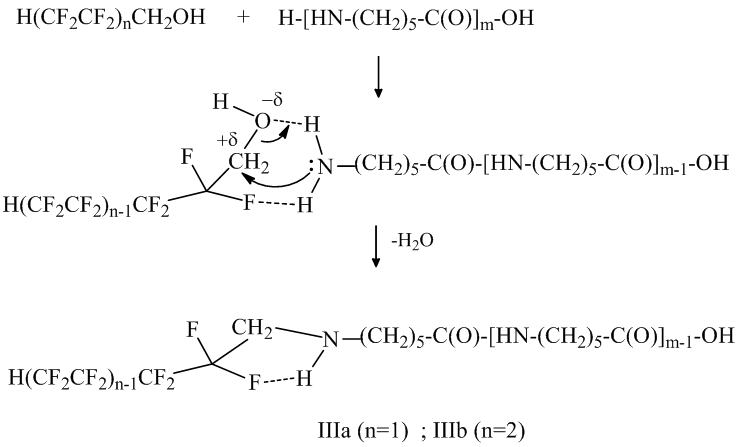
Формулы и молекулярная масса полученных олигомеров приведены в таблице 1.
Таблица 1. Полифторалкилированные олигокапроамиды
№ |
Формула |
Молекулярная масса |
Iа |
H-[HN-(CH2)5-C(O)]m-O-CH2CF2CF2H |
7380 |
Iб |
H-[HN-(CH2)5-C(O)]m-O-CH2(CF2CF2)2H |
9160 |
IIа |
HCF2CF2CH2-[HN-(CH2)5-C(O)]m-O-CH2CF2CF2H |
8350 |
IIб |
H(CF2CF2)2CH2-[HN-(CH2)5-C(O)]m-O- CH2(CF2CF2)2H |
9480 |
IIIа |
HCF2CF2CH2 H-[HN-(CH2)5-C(O)]m-OH |
7100 |
IIIб |
H(CF2CF2)2CH2-[HN-(CH2)5-C(O)]m-OH |
6520 |
IVа |
HCF2CF2CH2-[HN-(CH2)5-C(O)]m-O-CH2CF2CF2H |
6130 |
IVб |
H(CF2CF2)2CH2-[HN-(CH2)5-C(O)]m-O- CH2(CF2CF2)2H |
4560 |
Строение полифторалкилированных олигомеров изучено методом ИК – спектроскопии. Характеристические частоты поглощения в ИК – спектрах исходного и полифторалкилированных олигомеров приведены в таблице 2.
В области бóльших волновых чисел 3571-3272 см -1 отмечена интенсивная полоса поглощения для амидных NH-групп, с частотой 3284-3272 см -1, которая по своему положению и интенсивности меняется в небольших пределах. Полоса поглощения 3116 см -1 в исходном олигомере имеет среднюю интенсивность, в нерастворимых в горячей воде олигомерах IIа, IIб и IVа, IVб аналогичное поглощение наблюдается в интервале 3072-3066 см -1. Смещение полосы поглощения объясняется ассоциацией NH- группы, образующейся в процессе полифторалкилирования концевой NH2-группы олигомера с атомами фтора ближайшей CF2-группы:
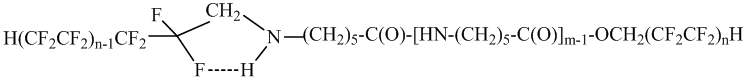
Доказательством присутствия H(CF2CF2)2CH2 – группы кроме содержания фтора в молекуле олигомеров является полоса поглощения 1176 см -1, соответствующая ассиметричному деформационному колебанию связи C – F. Отсутствие ассоциации CF2-группы с атомом водорода H-N-группы в олигомерах Iа и Iб приводит к смещению этой полосы поглощения в область бóльших волновых чисел (1184 см -1).
Наличие сложноэфирной группы в олигомерах Iа, Iб и IIа, IIб очевидно в связи с поглощением в области валентных колебаний сложноэфирной группы с νC=O = 1748-1752 см -1.
Отличие в содержании фтора для водонерастворимых олигомеров II и IV объясняется в разнице их молекулярной массы, что связано с реакцией полифторированного спирта по амидным группам исходного олигомера. Высокое содержание фтора в олигомере IV, полученном кипячением в полифторированном спирте 5.48 – 6.67 % и, следовательно, его меньшая молекулярная масса (4500-6100) объясняется также алкоголизом олигомера с разрывом амидной связи и образованием ε-капролактама или циклических олигомеров:
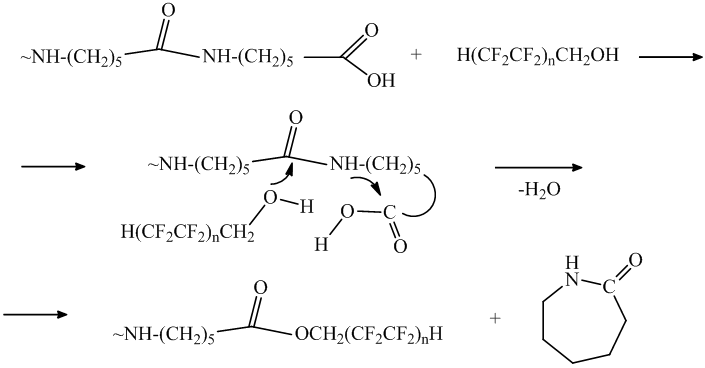
Полифторалкилированные олигомеры I, III представляют собой белые кристаллические вещества, растворимые в воде (содержание фтора 1.03-1.66 и 1.07-2.33% соответственно). Увеличение содержания фтора в олигомерах II и IV (1.82-6.67 %) ухудшает их растворимость в воде, такие олигомеры рекомендуются для испытаний в резино-технических изделиях с целью уменьшения истирания в процессе эксплуатации.
После выделения из реакционной массы нерастворимого в кипящей воде олигомера, а также выпадающего из воды при охлаждении до 20 °С, из водного маточного раствора после концентрирования также выпадает олигомер, содержащий небольшое количества фтора (0.29-1.0%). Очень хорошую растворимость в воде этой фракции можно объяснить, с одной стороны, наличием циклических олигомеров, хорошо растворяющихся в воде и возгоняющихся при высокой температуре, с другой стороны, низкомолекулярные олигомеры с n ≤ 20-30 также хорошо растворяются в воде. Наличие фтора в этом продукте позволяет предположить, что он состоит из смеси полифторалкилированного по аминогруппе низкомолекулярного олигомера (свободная карбоксильная группа способствует его растворимости) и циклического нефторированного олигомера.
Таким образом, из олигомерных отходов производства поликапроамида реакцией с полифторалкилхлорсульфитами или полифторированными спиртами можно целенаправленно получить моно-О-, моно-N- и ди-N,O-полифторалкилированные олигомеры с содержанием фтора 1.03-6.67% и молекулярной массой от 4560 до 9480. В отличие от процесса N-полифторалкилирования, характерного для реакции полифторированного спирта, реакция полифторалкилхлорсульфита с олигомером в присутствии триэтиламина идет в мягких условиях, преимущественно по карбоксильной группе и приводит к образованию водорастворимого O-полифторалкилированного олигомера I.
Экспериментальная часть
Строение полученных веществ доказано ИК- спектроскопией. ИК-спектры полученных веществ снимали на приборе «Spekord – M82», в суспензии с вазелиновым маслом.
1. Разделение олигомерных отходов производства поликапроамида
Олигомерные отходы измельчали, обрабатывали водой при температуре 20 – 25 °С и отделяли легко растворимые ε-капролактам и низкомолекулярные олигомеры. Циклические олигомеры извлекали этиловым спиртом. Остаток кипятили в воде и фильтровали при температуре 80–90 °С. Из фильтрата после охлаждения выпадал белый кристаллический олигокапроамид. Методом потенциометрического титрования концевых H2N- и НООС- групп было определено, что олигокапроамид H[HN(CH2)5C(O)]mOH имеет в среднем m = 60 – 80.
2. Полифторалкилирование олигокапроамида 1,1,5-тригидроперфторпентил-хлорсульфитом в присутствии триэтиламина
В реактор, снабженный мешалкой, термометром, обратным холодильником загружали 2.5 г (0.27·10-3 моль ) олигомера, 0.6 мл (0.004 моль) триэтиламина и 15 мл хлороформа, охладили реакционную смесь до -10°С и, поддерживая эту температуру, дозировали раствор 2.18 г (0.004 моль) 1,1,5-тригидроперфторпентилхлорсульфитам в 5 мл хлороформа. Затем температуру медленно повысили до 60-65 °С и выдерживали при перемешивании 2ч. Олигомерный продукт отфильтровали, промыли хлороформом, перекристаллизовывали из воды. Получили: нерастворимый в воде продукт (IIб) 0.39 г, (15.6 %), т. пл. 220-228°С, содержание фтора 3.19 %; растворимый в воде продукт (Iб) 0.93 г (37.2 %), т. пл. 225-227°С, содержание фтора 1.66 % .
Реакцию с 1,1,3-тригидроперфторпропилхлорсульфитом проводили аналогично, данные представлены в таблице 2.
3. Полифторалкилирование олигокапроамида 1,1,5-тригидроперфторпентанолом-1
В трехгорлый реактор, снабженный мешалкой, термометром, обратным холодильником загрузили 8 мл (0.05 моль) 1,1,5-тригидроперфторпентанола и 4.95 г (0.54·10-3 моль) олигокапроамида. Реакционную массу нагревали до кипения и выдерживали в течение 12 ч. После охлаждения реакционной смеси ее разбавляли 20 мл ацетона. Выпавший белый осадок отфильтровывали, и экстрагировали кипящей водой растворимую в ней часть. Получен нерастворимый в воде олигомер IVб в количестве 0.59 г (11.9 %) с т.пл. 215-220 °С и содержанием фтора, равным 6.67 %. После охлаждения из водного раствора выделено 2.26 г (45.7 %) олигомера IIIб с т.пл. 232-240 °С и содержанием фтора, равным 2.33 %. Реакцию с 1,1,3-тригидроперфторпропанолом-1 проводили аналогично, данные представлены в таблице 2.
Таблица 2. Физико-химические свойства исходного и полифторалкилированных олигомеров
|
№ |
Олигомер |
Выход, % |
Т.пл., ºС |
Содержание элемента, % |
Растворимость в кипящей воде |
Характеристические частоты в ИК- спектрах, см -1 |
|||||
|
NH амидная |
NH (NH2) аминная |
C(O)ORF Сложно-эфирная* |
COOH |
CF2 |
|||||||
|
N |
F |
||||||||||
|
1 |
Исходный |
- |
220-222 |
12.2 |
- |
раств. |
3284с |
(3116ср) |
- |
1716ср |
- |
|
2 |
Iа |
24.8 |
235-240 |
12.1 |
1.03 |
раств. |
3286с |
3084ср |
1748сл |
- |
1183ср |
|
3 |
Iб |
37.2 |
227-235 |
12.0 |
1.66 |
||||||
|
4 |
IIа |
10.0 |
230-235 |
9.9 |
1.82 |
нераств. |
3271с |
3067ср |
1746сл |
- |
1177ср |
|
5 |
IIб |
15.6 |
220-228 |
9.8 |
3.19 |
||||||
|
6 |
IIIа |
45.6 |
230-235 |
11.8 |
1.07 |
раств. |
3280с |
3076ср |
- |
1716сл |
1176ср |
|
7 |
IIIб |
45.7 |
232-240 |
10.9 |
2.33 |
||||||
|
8 |
IVа |
13.2 |
235-245 |
8.9 |
2.48 |
нераств. |
3280с |
3072ср |
1752сл |
- |
1176ср |
|
9 |
IVб |
11.9 |
215-220 |
9.9 |
6.67 |
||||||
Список литературы
- Сторожакова Н. А. Модификация полифторированными спиртами – теломерами поли-ε-капроамида и его свойства. Автореферат дис. канд. хим. наук. Волгоград, 1998 г.- 23 с.
- Ефанова Е. Ю. Катализ реакции ε-капролактама с предельными незамещенными и полифторированными одноатомными спиртами в синтезе олигомеров. Автореферат дис. канд. хим. наук. Волгоград, 2002. – 18 с.
- Косенкова С. А. Исследование закономерностей каталитических реакций ε-капролактама со спиртами. Автореферат дис. канд. хим. наук. Волгоград, 2007. – 20 с.
- Киселев О. И., Деева Э. Г. Противовирусные препараты. Обзор. НИИ Гриппа РАМН, Санкт-Петербург. Посвящен 100-летию клиники им. проф. Меньшикова В. К.- Казань. 2001.- 32 с.
- Рахимов А. И. Синтез полифторалкилхлорсульфитов и новые реакции полифторалкилирования с их участием / А. И. Рахимов // Журнал общей химии. - 2010. - Т. 80, вып. 8. - C. 1315-1334.
- Влияние полифторалкильных групп в сополимере акриламид-акрилат Na на свойства его низкоконцентрированных водных растворов / А. И. Рахимов, Д. А. Вершинин, А. В. Мирошниченко, О. С. Рахимова // Фторные заметки : on-line журнал. - 2011. - № 4. - C. notes.fluorine1.ru/public/2011/4_2011/letters/rusindex.html
- Рахимов А. И. Особенности получения фениловых эфиров с помощью полифторалкилхлорсульфитов / А. И. Рахимов, А. В. Мирошниченко // Фторные заметки: on-line журнал. - 2011. - № 6. - C. /public/2011/6_2011/letters/rusindex.html
- Влияние заместителей в аллиловом спирте на реакцию с полифторалкилхлорсульфитами / А. И. Рахимов, Г. И. Никишин, А. В. Мирошниченко, Фыонг Тхао До Зыонг // Фторные заметки : on-line журнал. - 2011. - № 5. - /public/2011/5_2011/letters/rusindex.html
Статья рекомендована к публикации членом редколлегии проф. А.И. Рахимовым
Fluorine Notes, 2016, 107, 3-4
