Received: июль, 2011
Fluorine Notes, 2011, 79, 3-4
Особенности получения фениловых эфиров с помощью полифторалкилхлорсульфитов
А.И. Рахимов, А.В. Мирошниченко
Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация. Исследован синтез фениловых эфиров реакциями полифторалкилхлорсульфитов с фенолятом натрия, с фенолами в присутствии оснований и при катализе N,N-диметилформамидом. Каталитическим синтезом получены фенилполифторалкиловые эфиры с выходом до 82.9%.
Ключевые слова: Фенол, фенолят, фениловые эфиры, полифторалкоксибензолы, полифторалкилхлорсульфиты, фенилполифторалкилсульфит, N,N-диметилформамид.
Полифторалкиловые эфиры фенола ранее получены взаимодействием бромбензола, п-бромтолуола с алкоголятами полифторированных спиртов в присутствии меди в пиридине [1]. Невысокий выход (48.5 – 60%), жесткие условия реакции (110-120 °С, 22 ч) и применение токсичного пиридина значительно затрудняют применение этого метода.
Известно также, что полифторалкилхлорсульфиты (ПФАХС) реагируют с 1-адамантанолом в присутствии гидроксида натрия в диоксане с образованием 1-(полифторалкокси)адамантана с выходом до 76% [2].
По каталитической N,N-диметилформамидом (ДМФА) реакции ПФАХС с предельными одноатомными и жирноароматическими спиртами получены простые эфиры [3-6].
В данной работе проведено сравнение известного ранее метода синтеза полифторалкиловых эфиров фенола [1] с новыми реакциями ПФАХС с фенолятом натрия, с фенолами в присутствии основания (NEt3, K2CO3) и при катализе ДМФА.
Фенол вводили в реакцию с ПФАХС с эквимолярным количеством триэтиламина (ТЭА), который, по-видимому, аналогично работе [7] реагирует через шестичленное переходное состояние:
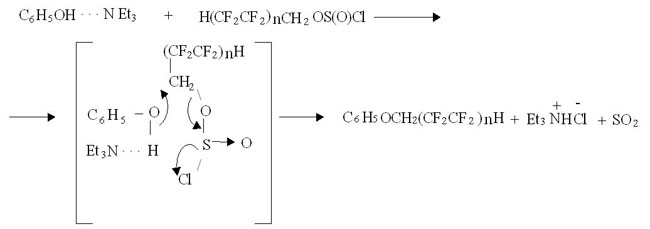
Раствор ПФАХС дозировали в предварительно приготовленный комплекс фенола с ТЭА при -10 ÷ -5°С, затем выдерживали реакционную смесь 5 – 6 часов при комнатной температуре. В качестве растворителя применяли пентан, гексан или хлороформ, поскольку образующийся хлорид триэтиламмония в них не растворим, выпадает и легко удаляется из реакционной смеси. По этому методу получены полифторалкиловые эфиры фенола с выходом 42.5 – 51.0 %. Недостатками этого метода является применение в больших количествах ТЭА и, как следствие, образование побочного продукта - хлорида триэтиламмония. Образование соли идет с выделением тепла, что способствует протеканию побочных реакций и снижению выхода эфира. Кроме того, хлорид триэтиламмония является нежелательным загрязнителем продукта реакции, от которого трудно избавиться.
Другим использованным нами методом была реакция фенолятов натрия или калия с ПФАХС. Однако, в этом случае получен низкий выход полифторалкиловых эфиров фенола (до 35 %). Еще ниже (всего 16.2 %) оказался выход эфира по реакции фенола с ПФАХС в присутствии карбоната калия. Это можно объяснить образованием в условиях реакции смешанного (несимметричного) сульфита – фенилполифторалкилсульфита, который претерпевает ряд превращений, аналогично смешанным ангидридам карбоновых и алкилсульфиновых кислот [8]:
C6H5ONa + Cl-S(O)O-CH2Rf → C6H5O-S(O)O-CH2Rf + NaCl
C6H5OH + K2CO3 + Cl-S(O)O-CH2Rf → C6H5O-S(O)O-CH2Rf +KCl +KHCO3
Rf = (CF2CF2)nH, n = 1, 2.
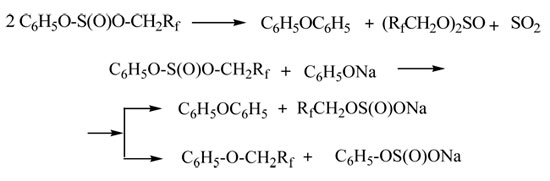
Смешанный сульфит при нагревании в присутствии основания диспропорционирует с образованием дифенилового эфира, алкил (фенил) сульфинатов и симметричных диалкилсульфитов, которые могут далее приводить к фениловым эфирам:
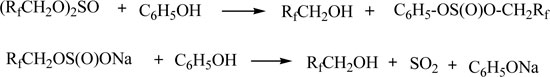
В присутствии фенола сульфиты и сульфинаты могут разлагаться до полифторированного спирта:
Нами установлено, что наиболее перспективным является новый каталитический синтез полифторалкиловых эфиров реакцией фенолов с ПФАХС :
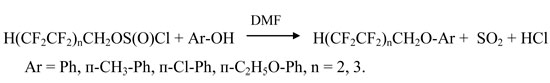
Реакцию проводили в присутствии растворителя (тетрахлорметан, хлороформ, гептан, эфир). Реагенты смешивали при температуре –10 ÷ –5 °С, причем полифторалкилхлорсульфит дозировали в раствор фенола в смеси с ДМФА (DMF) при их мольном соотношении равном (1- 1.1) : 1: 0.02 соответственно. Реакцию вели при 30 °С в течение 6 ч. Выделяющиеся газообразные продукты реакции (диоксид серы и хлористый водород) удаляли осушенным воздухом. Выход эфиров, полученных разными методами, и их физико-химические свойства представлены в таблице.
Таблица. Полифторалкилфениловые эфиры.
|
# |
Формула |
Выход, % |
Т. кип., °С / мм рт. ст. |
d204 |
nD20 |
|
1 |
C6H5OCH2CF2CF2H |
42.52 50.03 |
53/3 |
1.4378 |
1.4508 |
|
2 |
C6H5OCH2(CF2CF2)2H |
71.31 51.02 48.53 |
90/1 |
1.5760 |
1.4040 |
|
3 |
C6H5OCH2(CF2CF2)3H |
74.81 56.03 |
99/1 |
1.5550 |
1.3950 |
|
4 |
п-Ме-C6H4-OCH2(CF2CF2)2H |
82.91 56.03 |
110/2 |
1.5280 |
1.4250 |
|
5 |
п-Ме-C6H4-OCH2(CF2CF2)3H |
69.61 57.33 |
106/1 |
1.5440 |
1.3960 |
|
6 |
п-Cl-C6H4-OCH2(CF2CF2)2H |
45.01 |
108/1 |
1.6020 |
1.4390 |
|
7 |
п-EtО-C6H4-OCH2(CF2CF2)2H | 45.51 |
115/1 |
1.4136 |
1.4385 |
1– каталитический синтез в присутствии ДМФА, 2– синтез в присутствии триэтиламина, 3– синтез из бромбензола (толуола) в пиридине.
Для каталитической ДМФА реакции ПФАХС с фенолами, как и для спиртов, имеет место нуклеофильное замещение хлорсульфитной группы на фенокси-группу с одновременным выделением хлористого водорода и диоксида серы с образованием полифторалкиловых фенолов.
Фенолы, обладая кислотными свойствами, ассоциируют с ДМФА, образуя донорно-акцепторные комплексы (I), устойчивые при низких температурах:
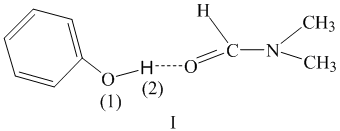
В ассоциате (I) за счет образования водородных связей происходит поляризация и удлинение связи Н(2)- О(1), что увеличивает подвижность протона.
Первая стадия реакции включает взаимодействие ассоциата (I) с молекулой ПФАХС. При этом образуется шестичленный комплекс (II) за счет взаимодействий между атомами О(1)···С(3) и Н(2)···Cl. Высокая электронная плотность на атоме хлора и значительный положительный заряд на протоне гидроксильной группы фенола благоприятствуют его образованию:
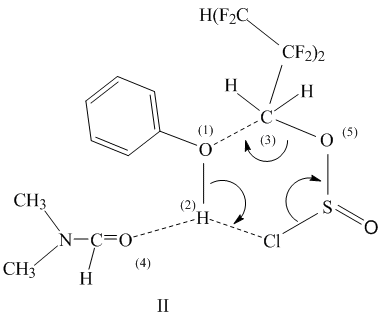
На второй стадии в комплексе происходит переход протона Н(2) к полярному атому хлора и одновременный разрыв связей С(3)-O(5), S-Cl с выделением SO2 и HCl, а также с регенерацией молекулы ДМФА и образованием полифторалкилового эфира фенола:
II → H(CF2CF2)nCH2O-C6H5 + SO2 + HCl + HC(O)-N(CH3)2
Ранее установлено [4], что с введением в молекулу спирта фенильного или другого заместителя (на примере бензилового спирта), обладающего электроноакцепторным эффектом, за счет более сильной поляризации связи Н(2) -О(1), возрастает подвижность протона (кислотность), что приводит к увеличению реакционной способности спирта в реакции с полифторалкилхлорсульфитом. С другой стороны, введение электроноакцепторных групп снижает электронную плотность на атоме кислорода и нуклеофильность спирта, тем самым затрудняя его взаимодействие с атомом углерода в полифторалкилхлорсульфите.
Кинетические исследования показывают, что в случае спиртов перенос протона является лимитирующим фактором, определяющим образование продуктов реакции [6].
Особенностью реакции ПФАХС с фенолами является то, что фенолы, обладая боле сильными кислотными свойствами, чем одноатомные спирты, являются в тоже время и более слабыми нуклеофилами. По-видимому, именно это определяет их меньшую реакционную способность. Было установлено, что введение сильного электроноакцепторного заместителя (нитрогруппы) настолько снижает реакционную способность фенола, что полифторалкиловый эфир фенола получить не удается.
Экспериментальная часть
ИК – спектры жидких веществ снимали на приборе "Spekord – M82" в тонком слое (жидкая пленка). ПМР – спектры веществ снимали на приборе Mercury-300 (Varian), рабочая частота 300 МГц, внутренний стандарт тетраметилсилан, растворитель – четыреххлористый углерод.
1. Синтез 1-(2,2,3,3–тетрафторпропокси)бензола (C6H5OCH2CF2CF2H ).
Фенол -3.45 г (0.04 моль) и 3.71 г (0.04 моль) триэтиламина смешали до полного растворения в 15 мл пентана, охладили до – 10°С и при этой температуре при перемешивании дозировали раствор 7.87 г (0.04 моль) 1,1,3-тригидроперфторпропилхлорсульфита в 20 мл пентана, поддерживая температуру. Реакционную смесь оставили при комнатной температуре на сутки. Отфильтровали хлористоводородную соль триэтиламина, отогнали пентан, продукт перегоняли в вакууме. Выход 3.24 г, 42.5 %, т. кип. 53 °С (3 мм рт. ст.), nD20 1.4508 , d204 1.4378. ИК-спектр, ν, см –1: 2932 (СН2), 1604, 1504 (Ph), 1239, 1032 (νC-О-С), 1192 (νCF2).
2. Синтез 1-(2,2,3,3,4,4,5,5–октафторпентокси)бензола
C6H5OCH2(CF2CF2)2H
Фенол- 2.05 г (0.0216 моль) растворили в 30 мл хлороформа, смешали с 0.034 мл (0.0004 моль) ДМФА, охладили до –10 °С и дозировали раствор 6.80 г (0.0216 моль) 1,1,5-тригидроперфторпентилхлорсульфита в 10 мл хлороформа, поддерживая температуру –10 °С. После смешения реагентов температуру реакционной смеси повышали до 30 - 35 °С и выдерживали 6 часов при постоянной продувке осушенным воздухом. Хлороформ отгоняли, продукт перегоняли в вакууме. Выход 4.75 г, 71.3%, т.кип. 90 °С (1 мм рт. ст.), nD20 1.4040, d204 1.5760. ИК-спектр, ν, см –1: 1150с (νС-О-С); 1203сш, 1256с (νCF2); 1317ср, 1441ср, 1485ср; 1529с, 1635ср, 1644ср (Ph); 2897сл, 2959ср, 3012ср (νCH2); 3065сл (CHF2). ПМР-спектр, δ, м.д.: 6.84 и 7.16 мультиплет (5Н С6Н5); 6.05 тт (53.0, 4.0) (1Н, HCF2); 4.47 т (12) (2Н, O-СН2-CF2).
3. Синтез 1-(2,2,3,3,4,4,5,5,6,6,7,7–додекафторгептилокси)бензола.
C6H5OCH2(CF2CF2)3H
Получали аналогично примеру 2, каталитическим методом в присутствии ДМФА. Выход 74.8 %, т.кип. 99 °С (1 мм рт. ст.), nD20 1.3950, d204 1.5550. ИК-спектр, ν, см –1: 665с, 752с, 821с, 895ср, 939ср, 1000ср, 1061с, 1113сл, 1178сш (νС-О-С); 1239сш, 1283сш (νCF2); 1452ср, 1496ср; 1530с, 1635с (Ph); 1704сл, 1830сл, 1915сл, 1987сл; 2896сл, 2969ср, 3013ср (νCH2); 3065сл, 3117сл (CHF2).
4. Синтез 1-(2,2,3,3,4,4,5,5-октафторпентокси)-4-метилбензола.
4-CH3-C6H4-OCH2(CF2CF2)2H
Получали аналогично примеру 2, каталитическим методом в присутствии ДМФА. Выход 82.9 %, т.кип. 110 °С (2 мм рт. ст.), nD20 1.4250, d204 1.5280. ИК-спектр, ν, см –1: 1150с (νС-О-С); 1203сш, 1256с (νCF2); 1317ср, 1441ср, 1485ср; 1529с, 1635ср, 1644ср (Ph); 2897осл, 2959ср, 3012ср (ν CH2, СН3); 3065сл (CHF2). ПМР-спектр, δ, м.д. (КССВ, J, Гц): 7.038д (8.4) и 6.896д (8.7) (4Н, C6H4); 5.927 тт (51.6, 5.5) (1Н, HCF2); 4.413 дублет квартетов (108.5, 13.5) (2Н, СН2); 2.229 (3Н, СН3).
5. Синтез 1-(2,2,3,3,4,4,5,5,6,6,7,7-додекафторгептилокси)-4-метилбензола. 4-CH3-C6H4-OCH2(CF2CF2)3H
Получали аналогично примеру 2, каталитическим методом в присутствии ДМФА. Выход 69.6 %, т.кип. 106 °С (1 мм рт. ст.), nD20 1.3960, d204 1.5440. ИК-спектр, ν, см –1: 1150с (νС-О-С); 1203сш, 1256с (νCF2); 1317ср, 1441ср, 1485ср; 1529с, 1635ср,1644ср (Ph); 2897осл, 2959ср, 3012ср (ν CH2, СН3); 3065сл (CHF2). ПМР-спектр, δ, м.д. (КССВ, J, Гц): 7.052 мультиплет и 6.938 мультиплет (4Н, C6H4); 5.935 тт (52.2, 5.4) (1Н, HCF2); 4.421 дублет квартетов (100.5, 13.2) (2Н, СН2); 2.229 (3Н, СН3).
6. Синтез 1-(2,2,3,3,4,4,5,5-октафторпентокси)-4-хлорбензола.
4-Cl-C6H4-OCH2(CF2CF2)2H
Получали аналогично примеру 2, каталитическим методом в присутствии ДМФА. Выход 45.0 %, т.кип. 108 °С (1 мм рт. ст.), nD20 1.4390, d204 1.6020. ИК-спектр, ν, см –1: 613сл, 639сл, 682 и 710с, 770ср, 830с, 878с, 939ср, 990ср, 1043с, 1122ср, 1152сш (νС-О-С); 1213сш, 1262с (νCF2); 1317ср, 1395сл, 1430ср, 1487ср; 1513с, 1626ср, 1687ср (Ph); 1917сл, 2052сл; 2886сл, 2930сл, 2995ср, 3039сл (ν CH2, СН3); 3105сл, 3135сл (CHF2). ПМР-спектр, δ, м.д. (КССВ, J, Гц): 7.253мультиплет и 7.059мультиплет (4Н, С6Н4); 5.975 тт (52.2, 5.77) (1Н, HCF2); 4.430 дублет квартетов (97.8, 12.9) (2Н, СН2).
7. Синтез 1-(2,2,3,3,4,4,5,5-октафторпентокси)-4-этоксибензола.
4-CH3CH2О-C6H4-OCH2(CF2CF2)2H
Получали аналогично примеру 2, каталитическим методом в присутствии ДМФА. Выход 45.5 %, т.кип. 115 °С (1 мм рт. ст.), nD20 1.4385, d204 1.4136. ИК-спектр, ν, см –1: 665ср, 700сл, 761с, 821ср, 878ср, 930, 982, 1000, 1061с, 1087с, 1178сш (νС-О-С); 1213сш, 1282сш (νCF2); 1373ср, 1452с, 1504ср; 1540с, 1556с, 1643ср, (Ph); 1917сл, 2078сл; 2930сл, 2944сл, 2978ср, 3039с (ν CH2, СН3); 3100сл, 3160сл (CHF2).
Библиографический список
- Шелудько, Е. В. Фенил-α,α,ω-тригидроперфторалкиловые эфиры и их превращения // Журнал органической химии / Е. В. Шелудько, Н. Н. Калибабчук. - 1979. - Т.15., вып.8. - С.1661-1665.
- Рахимов, А. И. Полифторалкилхлорсульфиты – новые полифторалкилирующие агенты // Журнал органической химии / А. И. Рахимов, О. В.Вострикова. - 2002. - Т. 75., вып. 7. - С. 1185-1188.
- Рахимов, А. И. Новый метод синтеза полифторированных простых эфиров // Журнал органической химии / А. И. Рахимов, А. В. Налесная, О. В. Вострикова. - 2004. - Т. 74. , вып. 4. - С. 967.
- Рахимов, А. И. Реакция полифторалкилхлорсульфитов с бензиловыми спиртами // Журнал общей химии / А. И. Рахимов, Р. В. Фисечко. - 2007. - Т. 77, вып. 10. - C. 1750-1751.
- Рахимов, А. И. Новый метод синтеза полифторалкилциклогексиловых эфиров // Журнал общей химии / А. И. Рахимов, Р. В. Фисечко. - 2008. - Т. 78, вып. 2. - С.338.
- Рахимов, А. И. Особенности катализа реакции полифторалкил-хлорсульфитов с предельными одноатомными спиртами // Журнал общей химии / А. И. Рахимов, А. В. Налесная, Р. В. Фисечко. - 2008. - Т. 78, вып. 11. - C. 1842-1848.
- Рахимов, А. И. О-полифторалкилирование фенола полифторалкилхлорсульфитами // Журнал органической химии / А. И. Рахимов, А. В.Налесная, О. В. Вострикова. - 2003. - Т.39., вып.6. - С.949.
- Сигэру, Оаэ Химия органических соединений серы / Сигэру Оаэ. Пер с япон. под ред. Е. Н. Прилежаевой. - М.: Химия. - 1975. - 512с.
Материал рекомендован к публикации членом редколлегии А.И. Рахимовым
Fluorine Notes, 2011, 79, 3-4
