Received: декабрь 2014
Fluorine Notes, 2015, 99, 1-2
СИНТЕЗ НОВЫХ ПРОИЗВОДНЫХ АКРИДИНА С ФТОРСОДЕРЖАЩИМ 1,2,4- И 1,3,4-ОКСАДИАЗОЛЬНЫМ ФРАГМЕНТОМ
А.Ю. Ламанов, Т.Н. Кудрявцева
Курский государственный университет, 305000 г. Курск, ул. Радищева, 33
e-mail: labOS.kgu@mail.ru
Аннотация. Синтезированы новые фторсодержащие 1,2,4- и 1,3,4- оксодиазол акридины. Исследована реакционная способность пентафторфенильных производных с некоторыми нуклеофилами.
Ключевые слова: Акридин, фторированные оксадиазолы.
В настоящее время большое внимание уделяется поиску новых биологически активных веществ ряда акридина[1]. Разработаны и выпускаются фармацевтической промышленностью препараты на основе производных акридина: мепакрин, акрифлавин, амскарин [2]. Эти лекарственные средства предназначены для лечения малярии, инфекционных и онкологических заболеваний. Как и многие препараты, используемые при химиотерапии, выше перечисленные препараты обладают некоторыми недостатками, к числу которых относится токсическое действие на различные органы организма. Поэтому важной задачей стоящей перед химиками является разработка новых более эффективных лекарственных средств.
Одним из направлений работ, позволяющих решить эту задачу, является химическая модификация акридина. Введение фармакофорных групп в молекулу акридина позволит изменить как характер биологической активности, так и степень действия субстанции на организм.
В работах [3,4,5,6] показано, что такими фармакофорными фрагментами могут являться 1,2,4- и 1,3,4-оксадиазолы. Кроме того, существенное влияние на физиологическую активность биологически активных веществ оказывает введение в их молекулу атомов фтора. Так, в частности, введение фторсодержащего алкильного заместителя в молекулу акридона повышает его противомалярийные свойства [7].
Таким образом, целью работы являлось разработать методы синтеза и получить ряд соединений – фторсодержащих производных акридина с 1,2,4- и 1,3,4-оксадиазольным фрагментом.
Исходными соединениями для синтеза фторированных 1,3,4-оксодиазольных производных стали 2-(9-оксоакридин-10(9H) ил)ацетогидразиды [8]. Комбинируя соответствующий гидразид с трифторуксусным ангидридом, перфторпропионовым ангидридом или пентафторбензоилхлоридом, с последующей циклизацией полученного бис-ацилгидразида в полифосфорной кислоте (ПФК), с выходами 60-80 %, были получены акридины 1a-2c, содержащие 1,3,4-оксадиазольный фрагмент с фторированным заместителем.
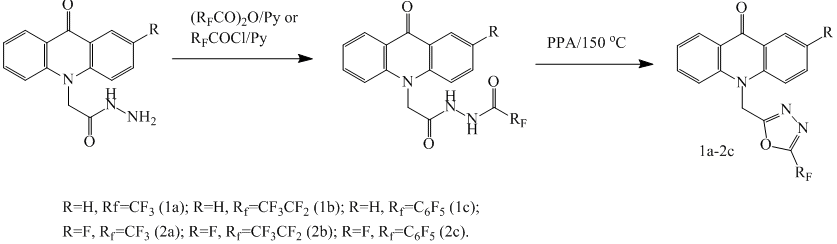
Для получения фторированных 1,2,4-оксадиазольных производных эффективным является метод с использованием амидоксимов и перфторированных ангидридов или хлорангидридов карбоновых кислот в качестве исходных полупродуктов [9,10]. Такой метод подходит для синтеза перфторированных 1,2,4-оксадиазол акридинов, в нашем случае он практически не дает побочных продуктов. Недостатком является стадия алкилирования акридона хлорацетонитрилом в системе гидрид натрия - N,N-диметилформамид(ДМФА), которая имеет конверсию 36-45 % (ВЭЖХ), что снижает выход целевых соединений. Амидоксимы получали взаимодействием нитрила акридонуксусной кислоты с гидроксиламином в спирте. Далее амидоксимы вводили в реакцию с трифторуксусным ангидридом, перфторпропионовым ангидридом или пентафторбензоил хлоридом в толуоле с пиридином, кипятили и получали целевые акридоны, содержащие 1,2,4-оксадиазольный фрагмент с перфторированным заместителем.
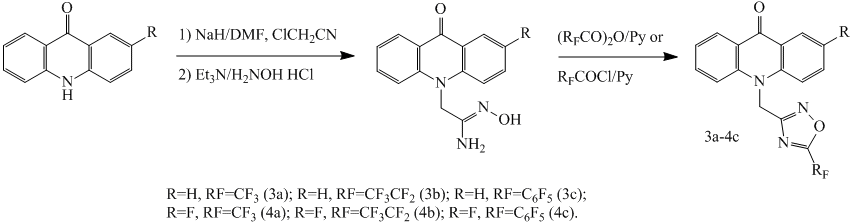
Известно[11], что атом фтора в 4-м положении перфторфенильного заместителя, связанного с 1,3,4-оксадиазольным фрагментом, обладаает высокой реакционной способностью и легко подвергается нуклеофильному замещению. Поэтому представляло интерес исследовать реакции соединений 1c, 2c с различными нуклеофилами. Так в частности при взаимодействии с аминами в среде ДМФА были получены соответствующие соединения 5a-6e, результаты приведены в таблице 1.
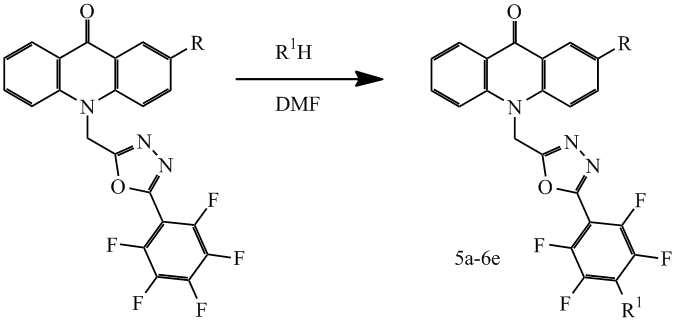
Таблица 1. Структура и выход соединений 5а-6е
Также для соединений 1c, 2c было исследовано взаимодействие с различными спиртами. В отличие от реакции с аминами, в обычных условиях реакция со спиртами не протекала. Сместить равновесие реакции вправо удалось при помощи K2CO3, однако и в этих условиях взаимодействие проходит значительно медленнее, а выход продуктов реакций несколько ниже, чем в реакции с аминами, результаты приведены в таблице 2.
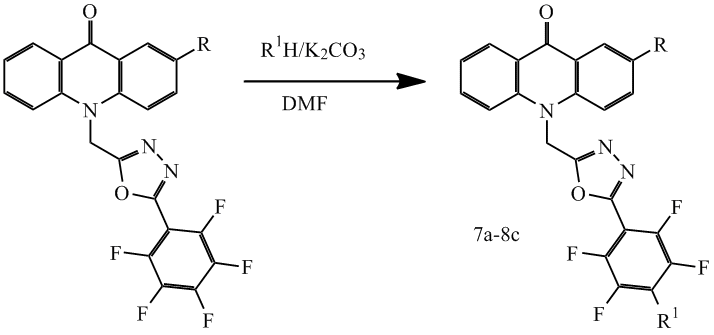
Таблица 2. Структура и выход соединений 7а-8с
Таким образом, получены целевые фторсодержащие производные акридина, включающие 1,3,4- и 1,2,4 оксадиазольный фрагмент, представляющие интерес для исследования биологической активности.
Экспериментальная часть
Контроль хода реакции и регистрацию масс-спектров синтезированных соединений осуществляли при помощи системы Dionex Ultimate 3000 с масс- спектрометрическим детектором LCQ Fleet, (Thermo Scientific) подвижная фаза: ACN, H2O, 1 % HCOOH. ЯМР 1Н спектры регистрировали на спектрометре Bruker AV-600, растворитель ДМСО-d6. Очистку полученных соединений проводили при помощи флэш-хроматографии на картридже с сферическим силикагелем, с размером частиц 30 мкм и массой 120 г (Interchim, PF 30SIHP/120G). Элюент – CH2Cl2 → CH2Cl2:MeOH - 10:1. Используемые в работе гетероциклические амины и спирты – коммерчески доступные реагенты.
Общая методика синтеза соединений 1a-2c
Гидразид акридон карбоновой кислоты 1.87 ммоль суспендируют в 5 мл ДМФА, добавляют 2 ммоль пиридина, затем 2 ммоль трифторуксусного ангидрида, или пентафторпропионового ангидрида или пентафторбензоил хлорида. Затем перемешивают 5 часов. По прохождении реакции гидразид растворяется. Затем смесь выливают в 50 мл воды, осадок фильтруют, промывают водой, сушат. Полученный полупродукт перемешивают с 8 г 84 % ПФК и нагревают 5 часов при 150 °С. Затем реакционную массу охлаждают и выливают в воду. Осадок фильтруют, сушат и очищают с помощью флэш-хроматографии.
10-((5-(трифторметил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (1a)
Кристаллическое вещество бледно-желтого цвета. Выход: 70 %, т.пл. 260-261 °С. Масс-спектр, m/z (Iотн (%)): 346 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.17 (с, 2 Н, C(1a)H2); 7.4 (ддд, C(2)H, С(7)Н, J = 7.93, J = 6.72, J = 1.03); 7.81-7.85 (м, 2 Н, C(4)H, C(5)H); 7.85-7.88 (м, 2 H, C(3)H, С(6)Н); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 8.13, J = 1.49).
10-((5-(перфторэтил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (1b)
Кристаллическое вещество желтого цвета. Выход: 63 %, т.пл. 177-178 °С. Масс-спектр, m/z (Iотн (%)): 414 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.20 (с, 2 Н, C(1a)H2); 7.41 (ддд, C(2)H, С(7)Н, J = 7.9, J = 6.81, J = 0.97); 7.82-7.85 (м, 2 Н, C(4)H, C(5)H); 7.86-7.89 (м, 2 H, C(3)H, С(6)Н); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 8.01, J = 1.37).
10-((5-(перфторфенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (1c)
Кристаллическое вещество бледно-желтого цвета. Выход: 80 %, т.пл. 222-223 °С. Масс-спектр, m/z (Iотн (%)): 444 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.25 (с, 2 Н, C(1a)H2); 7.40 (ддд, C(2)H, С(7)Н, J = 7.9, J = 6.92, J = 0.86); 7.86 (ддд, C(4)H, С(5)Н, J = 8.73, J = 6.95, J = 1.72); 7.91-7.95 (м, 2 H, C(3)H, С(6)Н); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 8.01, J = 1.6).
2-фтор-10-((5-(трифторметил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (2a)
Кристаллическое вещество желтого цвета. Выход: 67 %, т.пл. 263-264 °С. Масс-спектр, m/z (Iотн (%)): 364 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.18 (с, 2 Н, C(1a)H2); 7.41 (т, 1 Н, С(7)Н, J = 7.1); 7.73-7.78 (м, 1 Н, С(3)Н); 7.82-7.90 (м, 2 Н, С(4)Н, С(5)Н); 7.96 (дд, 1 Н, С(1)Н, J = 9.44, J = 3.9); 8.00 (дд, 1 Н, С(6)Н, J = 8.75, J = 3.15); 8.34-8.37 (м, 1 Н, С(8)Н).
2-фтор-10-((5-(перфторэтил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (2b)
Кристаллическое вещество желтого цвета. Выход: 60 %, т.пл. 199-200 °С. Масс-спектр, m/z (Iотн (%)): 414 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.21 (с, 2 Н, C(1a)H2); 7.40 (ддд, 1 H, C(7)H, J = 7.9, J = 6.87, J = 1.03); 7.75 (ддд, 1 H, C(3)H J = 9.44, J = 7.84, J = 3.20); 7.81-7.86 (м, 1 H, C(5)H); 7.86-7.90 (м, 1 H, C(4)H); 7.95-8.01(м, 2 Н, С(1)Н, С(6)Н); 8.35 (дд, 1 Н, С(8)Н J = 8.01, J = 1.60).
2-фтор-10-((5-(перфторфенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (2с)
Кристаллическое вещество желтого цвета. Выход: 77 %, т.пл. 228-229 °С. Масс-спектр, m/z (Iотн (%)): 462 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.27 (с, 2 Н, C(1a)H2); 7.41 (т, 1 Н, С(7)Н, J = 7.27); 7.76-7.83 (м, 1 Н, С(3)Н ); 7.87 (м, С(5)Н); 7.93 (д, 2 Н, С(4)Н, J = 8.7); 7.97-8.07 (м, 2 Н, С(1)Н, С(6)Н ); 8.36 (д, 1 Н, С(8)Н, J = 7.55).
Общая методика синтеза соединений 3a-4c
Акридон 10 ммоль суспендируют в 20 мл ДМФА, добавляют 11 ммоль гидрида натрия, перемешивают 15 минут, затем добавляют 11 ммоль хлорацетонитрила и перемешивают 4 часа. Затем выливают в 150 мл воды, и осадок фильтруют, промывают водой и сушат в вакууме. Полученный нитрил, 10 ммоль гидрохлорида гидроксиламина, 10 ммоль триэтиламина в 20 мл этанола кипятят 7 часов. Охлаждают, осадок фильтруют, промывают спиртом и сушат в вакууме. К амидооксиму в 20 мл толуола добавляют 10 ммоль пиридина охлаждают до 0 °С, затем добавляют 10 ммоль трифторуксусного или пентафторпропионового ангидрида или пентафторбензоил хлорида и перемешивают 3 часа. Затем перемешивают 4 часа при комнатной температуре и кипятят 3 часа. Горячий раствор фильтруют, промывают остаток несколько раз горячим толуолом. Фильтраты объединяют, упаривают, остаток очищают с помощью флэш-хроматографии.
10-((5-(трифторметил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (3a)
Кристаллическое вещество светло-желтого цвета. Выход: 17 %, т.пл. 190 -191 °С. Масс-спектр, m/z (Iотн (%)): 346 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.12 (с, 2 Н, C(1a)H2); 7.37-7.42 (м, C(2)H, С(7)Н, J = 7.95, J = 4.58, J = 3.26); 7.80-7.85 (м, 4 H, C(3)H, С(4)Н, C(5)H, С(6)Н); 8.38 (дт, 2 H, C(1)H, С(8)Н, J = 7.78, J = 1.14).
10-((5-(перфторэтил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (3b)
Кристаллическое вещество желтого цвета. Выход: 18 %, т.пл. 138-139 °С. Масс-спектр, m/z (Iотн (%)): 396 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.14 (с, 2 Н, C(1a)H2); 7.40 (ддд, C(2)H, С(7)Н, J = 7.95, J = 4.58, J = 3.26); 7.82-7.84 (м, 4 H, C(3)H, С(4)Н, C(5)H, С(6)Н); 8.37-8.39 (м, 2 H, C(1)H, С(8)Н).
10-((5-(перфторфенил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (3c)
Кристаллическое вещество бледно-желтого цвета. Выход: 19 %, т.пл. 160-161 °С. Масс-спектр, m/z (Iотн (%)): 444 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.15 (с, 2 Н, C(1a)H2); 7.39 (ддд, 2 H, C(2)H, C(7)H J = 7.90, J = 6.75, J = 1.03); 7.82-7.86 (м, 2 H, C(4)H, С(5)Н); 7.86-7.90 (м, 2 H, C(3)H, С(6)Н); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 7.95, J = 1.66).
2-фтор-10-((5-(трифторметил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (4a)
Кристаллическое вещество бледно-желтого цвета. Выход: 20 %, т.пл. 192-193 °С. Масс-спектр, m/z (Iотн (%)): 364 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.14 (с, 2 Н, C(1a)H2); 7.41 (ддд, 1 Н, С(7)Н J = 7.93, J = 4.95, J = 2.92); 7.76 (ддд, 1 Н, С(5)Н J = 9.44, J = 7.84, J = 3.2); 7.83-7.87 (м, 2 Н, С(3)Н, С(4)Н); 7.92-7.95 (м, 1 Н, С(1)Н ); 8.01 (дд, С(6)Н J = 8.81, J = 3.2); 8.35-8.37 (м, 1 Н, С(8)Н).
2-фтор-10-((5-(перфторэтил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (4b)
Кристаллическое вещество желтого цвета. Выход: 77 %, т.пл. 141-142 °С. Масс-спектр, m/z (Iотн (%)): 414 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.16 (с, 2 Н, C(1a)H2); 7.40 (ддд, 1 Н, С(7)Н J = 7.95, J = 5.09, J = 2.75); 7.76 (ддд, 1 Н, С(5)Н J = 9.41, J = 7.81, J = 3.26); 7.82-7.87 (м, 2 Н, С(3)Н, С(4)Н); 7.93 (дд, 1 Н, С(1)Н J = 9.5, J = 4,01); 8.01 (дд, 1 Н, С(6)Н J = 8.75, J = 3.15); 8.34-8.37 (м, 1 Н, С(8)Н).
2-фтор-10-((5-(перфторфенил)-1,2,4-оксадиазол-3-ил)метил)акридин-9(10H)-он (4с)
Кристаллическое вещество бледно-желтого цвета. Выход: 17 %, т.пл. 166-167 °С. Масс-спектр, m/z (Iотн (%)): 462 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.16 (с, 2 Н, C(1a)H2); 5.75 (с, 2 Н, C(1a)H2); 7.33 (дт, 1 Н, С(7)Н, J = 7.4, J = 0.9); 7.48(ддд, 1 H, C(3)H, J = 9.3, J = 7.4, J = 3.2); 7.71-7.78 (м, 3 Н, С(5)Н, С(4)Н, С(6)Н ; 8.14 (дд, 1 H, С(1)Н, J = 8.6, J = 3.1) 8.45 (д, 1 Н, С(8)Н, J = 8.01, J = 1.5).
Общая методика синтеза соединений 5a-6e
К 0.226 ммоль компонента 1c или 2c в 1 мл ДМФА добавляют 0.23 ммоль амина и перемешивают 3-8 часов при комнатной температуре. Затем раствор выливают в 20 мл воды, осадок фильтруют, сушат и очищают с помощью флэш-хроматографии.
10-((5-(2,3,5,6-тетрафтор-4-(4-метилпиперазин-1-ил)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (5a)
Кристаллическое вещество желтого цвета. Выход: 91 %, т.пл. 222-223 °С. Масс-спектр, m/z (Iотн (%)): 524 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.35 (уш. с. 3 H, C(5a) H3); 2.55-2.7 (м, 4 H, C(2a) H2, C(2b) H2); 3.2-3.5 (м, 4 H, C(3a) H2, C(3b) H2); 6.06 (с, 2 Н, C(1a)H2); 7.32 (т, 2 H, C(2)H, C(7)H, J = 7.34); 7.77 (ддд, 2 Н, C(4)H, C(5)H, J = 8.67, J = 7.01, J = 1.6); 7.84 (д, 2 H, C(3)H, C(6)H, J = 8.7); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 7.9, J = 1.6).
10-((5-(2,3,5,6-тетрафтор-4-(пиридин-2-илметиламино)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (5b)
Кристаллическое вещество желтого цвета. Выход: 81 %, т.пл. 218-219 °С. Масс-спектр, m/z (Iотн (%)): 532 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 4.69 (д, 2Н, С(2а)Н2, J = 6.5); 6.18 (с, 2 Н, C(1a)H2); 7.25-7.29 (м, Н, C(4а)H); 7.8 (д, 1 Н, С(6а)Н, J = 7.8); 7.39 (дт, 2 H, C(2)H, C(7)H J = 7.4, J = 0.8); 7.43-7.47 (м, NH); 7.77 (дт, 1 Н, С(5а)Н, J = 7.7, J = 1.8); 7.85 (ддд, C(4)H, С(5)Н, J = 8.7, J = 6.9, J = 1.8); 7.9-7.93 (м, 2 H, C(3)H, С(6)Н); 8.38 (дд, 2 H, C(1)H, С(8)Н, J = 8, J = 1.7). 8.5-8.52 (м, 1 Н, C(3а)H).
10-((5-(4-(циклопропиламино)-2,3,5,6-тетрафторфенил)-1,3,4- оксадиазол-2-ил)метил)акридин-9(10H)-он (5c)
Кристаллическое вещество бледно-желтого цвета. Выход: 70 %, т.пл. 219-220 °С. Масс-спектр, m/z (Iотн (%)): 481 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 0.61-0.73 (м, 4 Н, С(3а)Н2, С(3b)Н2); 2.85-2.91 (м, 1 Н, С(2а)Н2); 6.19 (с, 2 Н, C(1a)H2); 7.15-7.17 (м, NH); 7.40 (тд. 2 H, C(2)H, C(7)H, J = 7.44, J = 0.8); 7.85 (ддд, 2Н C(3)H, C(6)H J = 8.73, J = 6.95, J = 1.72); 7.93 (д, 2 C(4)H, C(5)H, J = 8.81); 8.38 (дд, 2 Н, C(1)H, С(8)Н, J = 8.01, J = 1.72).
10-((5-(2,3,5,6-тетрафтор-4-(3-гидроксипропиламино)фенил)-1,3,4- оксадиазол-2-ил)метил)акридин-9(10H)-он (5d)
Кристаллическое вещество бледно-желтого цвета. Выход: 62 %, т.пл. 227-228 °С. Масс-спектр, m/z (Iотн (%)): 499 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.68-1.74 (м, 2Н, С(3а)Н2); 3.42-3.50 (м, 4Н, С(2а)Н2, С(4а)Н2); 4.56 (т, ОH, J =5.04); 6.18 (с, 2 Н, C(1a)H2); 6.78-6.85 (м, NH); 7.37-7.42 (м, 2 H, C(2)H, C(7)H); 7.85 (ддд, 2Н C(3)H, C(6)H J = 8.7, J = 6.98, J = 1.72); 7.92 (м, 2 H, C(4)H, C(5)H); 8.37 (дд, 2 Н, C(1)H, С(8)Н, J = 7.95, J = 1.66).
этил 2-(2,3,5,6-тетрафтор-4-(5-((9-оксоакридин-10(9H)-ил)метил)-1,3,4-оксадиазол-2-ил)фениламино)ацетат (5e)
Кристаллическое вещество бледно-желтого цвета. Выход: 48 %, т.пл. 217-218 °С. Масс-спектр, m/z (Iотн (%)): 527 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.17-1.20 (м, 3 Н, С(4а)Н3); 4.12-4.16 (м, 4 Н, С(3а)Н2, С(2а)Н2 ); 6.18 (с, 2 Н, C(1a)H2); 7.24-7.29 (м, NH); 7.38-7.41 (м, 2 H, C(2)H, C(7)H,); 7.83-7.87(м, 2Н C(3)H, C(6)H); 7.91-7.94 (м, 2 C(4)H, C(5)H); 8.36-8.39 (м, 2 C(1)H, C(8)H).
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(4-метилпиперазин-1-ил)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (6a)
Кристаллическое вещество желтого цвета. Выход: 89 %, т.пл. 220-221 °С. Масс-спектр, m/z (Iотн (%)): 542 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.27 (уш. с. 3 H, C(5a) H3) 2.43-2.51 (м, 4 H, C(2a) H2, C(2b) H2); 3.29-3.39 (м, 4 H, C(3a) H2, C(3b) H2); 6.02 (с, 2 Н, C(1a)H2); 7.31 (т, 1 Н, С(7)Н, J = 7.4); 7.51-7.57(м,1 Н, С(3)Н); 7.76 (т, 1 Н, С(5)Н, J = 7.67); 7.79-7.84 (м, 1 Н, С(4)Н); 7.87-7.93 (м, 1 Н, С(6)Н); 7.87-7.92 (м, 1 H, С(1)Н); 8.36 (д, 1 Н, С(8)Н, J = 8.01).
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(пиридин-2-илметиламино)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (6b)
Кристаллическое вещество желтого цвета. Выход: 78 %, т.пл. 222-223 °С. Масс-спектр, m/z (Iотн (%)): 550 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 4.64-4.71 (м, 2Н, С(2а)Н2); 6.19 (с, 2 Н, C(1a)H2); 7.27 (ддд, 1 Н, C(4а)H, J = 7.47, J = 7.84, J = 1.09); 7.36 (д, 1 Н, С(6а)Н, J = 7.9); 7.38-7.42 (м, 1 Н, С(7)Н); 7.46 (т, NH, J = 6.52); 7.75-7.80 (м, 2 Н, С(3)Н, С(5а)Н); 7.84-7.87 (м, 1Н, C(5)H); 7.90-7.93(м, 1 Н, C(4)H); 7.99-8.03 (м, Н, C(1)H, C(6)H); 8.34-8.36 (м, 1Н, C(8)H); 8.51 (ддд, 1 Н, C(3а)H, J = 4.84, J = 1.75, J = 0.97).
10-((5-(4-(циклопропиламино)-2,3,5,6-тетрафторфенил)-1,3,4-оксадиазол-2-ил)метил)-2-фтор-акридин-9(10H)-он (6c)
Кристаллическое вещество желтого цвета. Выход: 75 %, т.пл. 233-234 °С. Масс-спектр, m/z (Iотн (%)): 499 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 0.61-0.73 (м, 4 Н, С(3а)Н2, С(3b)Н2); 2.85-2.91 (м, 1 Н, С(2а)Н2 ); 6.21 (с, 2 Н, C(1a)H2); 7.17 (д, NH, J = 2.06); 7.41 (ддд, 1 H, C(7)H, J = 7.93, J = 6.95, J = 0.8); 7.79 (ддд, 1 H, C(3)H, J = 9.44, J = 7.78, J = 3.26); 7.87 (ддд, 1 H, C(5)H, J = 8.75, J = 6.92, J =1.72); 7.91-7.94 (м, 1 Н, С(4)Н); 8.0-8.04 (м, 2 Н, С(1)Н, С(6)Н); 8.36 (дд, 1 Н, С(8)Н, J = 8, J = 1.7).
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(3-гидроксипропиламино)фенил)-1,3,4- оксадиазол-2-ил)метил)акридин-9(10H)-он (6d)
Кристаллическое вещество бледно-желтого цвета. Выход: 70 %, т.пл. 230-231 °С. Масс-спектр, m/z (Iотн (%)): 517 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.71 (квинтет, 2Н (С(3а)Н2, J = 6.58); 3.42-3.50 (м, 4Н, С(2а)Н2, С(4а)Н2); 4.30-4.75 (м, ОH); 6.19 (с, 2 Н, C(1a)H2); 6.78-6.85 (м, NH); 7.40 (тд. 1 H, C(7)H, J = 7.44, J = 0.8); 7.78 (ддд, 1 H, C(3)H, J = 9.41, J = 7.81, J = 3.26); 7.86 (ддд, 1 H, C(5)H, J = 8.75, J = 6.92, J = 1.72); 7.89-7.95 (м, 1 Н, С(4)Н); 8.01 (тд, 2 Н, С(1)Н, С(6)Н, J = 8.98, J = 3.66); 8.35 (дд, 1 Н, С(8)Н, J = 8.01, J = 1.6).
этил 2-(2,3,5,6-тетрафтор-4-(5-((2-фтор-9-оксоакридин-10(9H)-ил)метил)-1,3,4-оксадиазол-2-ил)фениламино)ацетат (6e)
Кристаллическое вещество бледно-желтого цвета. Выход: 56 %, т.пл. 223-224 °С. Масс-спектр, m/z (Iотн (%)): 545 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.19 (т. Н, 3 Н, С(4а)Н3, J = 7.1); 4.11-4.18 (м, 4 Н, С(3а)Н2, С(2а)Н2); 6.20 (с, 2 Н, C(1a)H2); 7.27 (т, NH, J = 6.58); 7.41 (тд. 1 H, C(7)H, J = 7.4, J = 0.9); 7.76-7.81 (м, 1 H, C(3)H); 7.84-7.89 (м, 1 H, C(5)H); 7.91-7.94 (м, 1 H, C(4)H); 7.99-8.05 (м, 2 Н, С(1)Н, С(6)Н); 8.36 (дд, 1 Н, С(8)Н, J = 8.01, J = 1.6).
Общая методика синтеза соединений 7a-8c
К 0.226 ммоль компонента 1c или 2c в 1 мл ДМФА добавляют 0.23 ммоль спирта, 0.23 ммоль K2CO3 и перемешивают 24 часа при комнатной температуре. Затем раствор выливают в 20 мл воды, осадок фильтруют, сушат и очищают с помощью флэш-хроматографии.
10-((5-(2,3,5,6-тетрафтор-4-(2-(пиперидин-1-ил)этокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (7a)
Кристаллическое вещество бледно-желтого цвета. Выход: 45 %, т.пл. 270-271 °С. Масс-спектр, m/z (Iотн (%)): 553 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.26-1.42 (м, 6Н, C(5a) H2, C(5b)H2, C (5с)H2); 2.29-2.48 (м, 4Н, C(4а) H2 C(4b) H2); 2.62-2.77 (м, 2Н, C(3а) H2); 4.42-4.51 (м, 2Н, C(2а) H2); 6.23 (с, 2 Н, C(1a)H2); 7.41 (т, 2Н, C(2)H, C(7)H, J = 7.72); 7.84-7.88(м, 2Н, C(3)H, C(6)H); 7.92-7.95 (м, 2 C(4)H, C(5)H); 8.37 (дд, 2 Н, C(1)H, С(8)Н, J = 7.95, J = 1.66).
10-((5-(2,3,5,6-тетрафтор-4-(2-морфолиноэтокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (7b)
Кристаллическое вещество светло-желтого цвета. Выход: 44 %, т.пл. 232-233 °С. Масс-спектр, m/z (Iотн (%)): 555 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.39-2.47 (м, 4 Н, С(4a)Н2, С(4b)Н2); 2.7-2.76 (м, 2 Н, С(3a)Н2); 3.43-3.5 (м, 4 Н, С(5a)Н2, С(5b)Н2); 4.48 (т, 2Н, C(2а) H2, J = 5.15); 6.23 (с, 2 Н, C(1a)H2); 7.41 (т, 2Н, , C(2)H, C(7)H, J = 7.38); 7.86 (ддд, 2Н, C(5)H, J = 8.7, J = 6.98, J = 1.72); 7.9-7.96 (м, 2 H, C(3)H, C(6)H); 8.3 (дд, 2 Н, C(1)H, С(8)Н, J = 7.9, J = 1.6).
10-((5-(2,3,5,6-тетрафтор-4-(2-(2-метил-5-нитро-1H-имидазол-1-ил)этокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (7c)
Кристаллическое вещество белого цвета. Выход: 49 %, т.пл. 185-186 °С. Масс-спектр, m/z (Iотн (%)): 595 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.52 (м, 3 Н, CH3); 4.74-4.80 (м, 4 Н, С(3a)Н2, С(2a)Н2); 6.22 (с, 2 Н, С(1a)Н2); 7.39 (ддд, 2Н, , C(2)H, C(7)H, J = 7.92, J = 6.95, J = 0.8); 7.84 (ддд, 2Н, C(5)H, J = 8.75, J = 6.92, J = 1.72); 7.90-7.93 (м, 2 H, C(3)H, C(6)H); 8.07 (с, 1 Н, С(1b)Н); 8.37 (дд, 2 Н, C(1)H, С(8)Н, J = 8.01, J = 1.6).
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(2-(пиперидин-1-ил)этокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (8a)
Кристаллическое вещество светло-желтого цвета. Выход: 43 %, т.пл. 270-271°С. Масс-спектр, m/z (Iотн (%)): 571 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 1.25-1.39 (м, 6Н, C(5a) H2, C(5b)H2, C (5с)H2); 2.27-2.43 (м, 4Н, C(4а) H2 C(4b) H2); 2.60-2.72 (м, 2Н, C(3а) H2); 4.44 (т, 2Н, C(2а) H2, J =4.86); 6.24 (с, 2 Н, C(1a)H2); 7.38-7.43 (м, 1 Н, С(7)Н); 7.75-7.80 (м, 1 Н, С(3)Н); 7.86 (ддд, 1 Н, C(5)H, J = 8.73, J = 6.95, J = 1.72); 7.93 (д, 1 Н, C(4)H, J =8.81); 7.98-8.05 (м, 2 Н, C(1)H, C(6)H); 8.33-8.36 (м, 1Н, C(8)H);
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(2-морфолиноэтокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (8b)
Кристаллическое вещество светло-желтого цвета. Выход: 40 %, т.пл. 240-241 °С. Масс-спектр, m/z (Iотн (%)): 573 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.37-2.47 (м, 4 Н, С(4a)Н2, С(4b)Н2); 2.68-2.76 (м, 2 Н, С(3a)Н2); 3.43-3.50 (м, 4 Н, С(5a)Н2, С(5b)Н2); 4.48 (т, 2Н, C(2а) H2, J = 5.21); 6.25 (с, 2 Н, C(1a)H2); 7.40-7.43 (м, 1 Н, С(7)Н); 7.79 (ддд, 1 Н, C(3)H, J = 9.38, J = 7.78, J = 3.2); 7.85-7.89 (м, 1Н, C(5)H); 7.92-7.95(м, 1 Н, C(4)H); 7.99-8.05 (м, 2 Н, C(1)H, C(6)H); 8.35-8.37 (м, 1Н, C(8)H).
2-фтор-10-((5-(2,3,5,6-тетрафтор-4-(2-(2-метил-5-нитро-1H-имидазол-1-ил)этокси)фенил)-1,3,4-оксадиазол-2-ил)метил)акридин-9(10H)-он (8c)
Кристаллическое вещество светло-желтого цвета. Выход: 52 %, т.пл. 190-191 °С. Масс-спектр, m/z (Iотн (%)): 613 [М+H]+ (100). ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 2.52 (с, 3 Н, CH3); 4.74-4.81 (м, 4 Н, С(3a)Н2, С(2a)Н2 ); 6.22 (с, 2 Н, С(1a)Н2); 7.39 (тд, 1 Н, С(7)Н, J = 7.44, J = 0.8); 7.77 (ддд, 1Н, C(3)H, J = 9.5, J = 7.78, J = 3.2); 7.85 (ддд, 1Н, C(5)H, J = 8.7, J = 6.92, J = 1.77); 7.9-7.93 (м, 1Н, C(4)H); 7.97-8.03 (м, 2 Н, C(1)H, C(6)H); 8.06 (с, 1 Н, С(1b)Н); 8.34 (дд, 1 Н, С(8)Н, J = 8.01, J = 1.6).
Работа выполнена при финансовой поддержке министерства образования и науки (научный проект N 1399 в рамках государственного задания N 2014/349 Министерства образования и науки Российской Федерации).
Список литературы
- T.N. Kudryavtseva, K.V. Bogatyrev, L.G. Klimova, E.A. Batuev. Synthesis and antibacterial activity of series fluorine-substituted acridoneacetic acid derivatives // Fluorine notes: online journal. 2014. N 3 (94), URL: /public/2014/3_2014/letters/index.html
- Kleemann A., Engel J. Pharmaceutical Substances. Stuttgart - New York: Thieme, 2001. 2409 с.
- Trilok Chandra, Neha Garg, Suman Lata, K.K. Saxena, Ashok Kumar. Synthesis of substituted acridinyl pyrazoline derivatives and their evaluation for anti-inflammatory activity // Eur. J. Med. Chem. 2010. V. 45, N. 5, P. 1772–1776
- Anees Pangal, Javed A. Shaikh. Various pharmacological aspects of 2, 5-disubstituted 1,3,4-oxadiazole derivatives: a Review // Res. J. Chem. Sci. 2013, V. 3(12), P. 79-89.
- Andrea Pace and Paola Pierro. The new era of 1,2,4-oxadiazoles // Org. Biomol. Chem. 2009, 7, 4337–4348.
- Jonas Boström, Anders Hogner, Antonio Llinàs, Eric Wellner, and Alleyn T. Plowright. Oxadiazoles in Medicinal Chemistry // J. Med. Chem. 2012, V. 55, N. 5, P. 1817−1830.
- Rolf W. Winter, Jane X. Kelly, Martin J. Smilkstein, Rozalia Dodean, Grover C.Bagby, R. Keaney Rathbun, Joshua I. Levin, David Hinrichs, Michael K. Riscoe. Evaluation and lead optimization of anti-malarial acridones // Experimental Parasitology. 2006, V. 114, N 1, P. 47–56.
- Ю. Д. Маркович, П. И. Сысоев, Т. Н. Кудрявцева, Н. Н. Сергеева, Л. Г. Климова. Синтез и исследование биологической активности арилиденгидразидов акридонуксусной кислоты // Ученые записки. Электронный научный журнал Курского государственного университета. 2013.N 3(27). Том 2. URL http://scientific-notes.ru/pdf/032-003.pdf.
- J.P. Critchley, J.S. Pippett. The synthesis and stability of some perfluoroalkyl- and perfluoroalkylene-1,2,4- and 1,3,4-oxadiazoles // Journal of Fluorine Chemistry. 1972, V. 2, N. 2, P. 137–156.
- Silvestre Buscemi, Andrea Pace, Antonio Palumbo Piccionello, Nicolò Vivona. Synthesis of fluorinated first generation starburst molecules containing a triethanolamine core and 1,2,4-oxadiazoles // Journal of Fluorine Chemistry. 2006. V. 127, N. 12, P. 1601–1605.
- Jianfu Ding and Michael Day. Novel Highly Fluorinated Poly(arylene ether-1,3,4-oxadiazole)s, Their Preparation, and Sensory Properties to Fluoride Anion // Macromolecules. 2006, V. 39, N. 18, P. 6054–6062.
Статья рекомендована к публикации членом редколлегии проф. А.Ф. Елеевым
Fluorine Notes, 2015, 99, 1-2
