Received: ноябрь, 2010
DOI 542.915:[547.569.1:546.16]:547.539.3
Fluorine Notes, 2011, 75, 5-6
ПОЛУЧЕНИЕ 1,4-ДИБРОМТЕТРАФТОРБЕНЗОЛА ИЗ 4-БРОМТЕТРАФТОРБЕНЗОЛТИОЛА И БРОМА. ПРЕВРАЩЕНИЯ 1,4-ДИБРОМТЕТРАФТОРБЕНЗОЛА С KSH
П.В.Никульшин,1 А.М.Максимов,1 В.Е.Платонов,1 А.И.Лотков,2 Л.Л.Мейснер.2
1)Учреждение Российской академии наук Новосибирский институт органической химии им. Н.Н.
Ворожцова Сибирского отделения РАН, г. Новосибирск, Россия,
e-mail: platonov@nioch.nsc.ru
2)Учреждение Российской академии наук Институт физики прочности и материаловедения
Сибирского отделения РАН, г. Томск, Россия
Аннотация. Пиролизом 4-бромтетрафторбензолтиола с бромом при 400°C разработан метод получения 1,4-дибромтетрафторбензола и изучена его реакция с KSH, приводящая, главным образом, к замене атомов брома на водород.
Ключевые слова. Ключевые слова: пиролиз, 1,4-дибромтетрафторбензол, KSH, галогенофильная реакция.
Бромсодержащие полифторарены являются важными продуктами для получения широкого круга полифторароматических соединений с различными функциональными группами [1,2]. Среди бромполифтораренов наиболее доступными являются бромполифторбензолы, получаемые обычно бромированием бромом соответствующих полифторбензолов в 65%-ном олеуме. Таким способом были синтезированы бромпентафторбензол (1) [3 ], изомерные дибромтетрафторбензолы [4,5,6]. Из 1,2,4-трифторбензола бромированием Br2 в присутствии алюминия получен 1,2,4-трибромтрифторбензол (2) [7].
Соединение 1 и 1,2-, 1,3- (3), и 1,4-дибромтетрафторбензолы (4) могут быть использованы для получения полифторированных полифениленов [2]. Перфторированные полифенилены рекомендованы для применения в качестве смазочных материалов и защитных покрытий технологического оборудования от воздействия радиоактивного излучения, агрессивных сред [8]. Для получения полифторированных полифениленов используются пентафторфенилмагний бромид, синтезированный из соединения 1, а также дибромтетрафторбензолы 3 и 4 вовлекаемые с этой целью в реакцию Ульмана [2].
Недавно нами был разработан метод введения брома в полифторарены путем замены тиольной группы атомом брома. Пиролизом пентафторбензолтиола (5) в присутствии брома при 500°C получено соединение 1 [9]. Другие монобромполифторарены были получены аналогичным способом. Данный подход казалось целесообразным распространить на получение полибромфтораренов. С этой целью доступный 4-бромтетрафторбензолтиол (6) [10] был использован для проведения реакции пиролиза в присутствии брома с целью получения соединения 4. Перед проведением реакции тиол 6 очищался перегонкой в вакууме. Перегнанный тиол 6 (98.5%) содержал в качестве основной примеси 4-хлортетрафторбензолтиол (~1%). Наличие последнего обусловлено содержанием небольшого количества хлорпентафторбензола в соединении 1; из этого продукта с помощью реакции с KSH [10] получают тиол 6, содержащий данную примесь. Как оказалось, температура реакции пиролиза тиола 6 в присутствии брома может быть понижена до 400°C вместо 500°C, используемой для получения соединения 1 и других бромполифтораренов [9]. При бромировании тиола 5 при 400°C замена тиольной группы бромом происходит не полностью, приводя к смеси соединения 1 и декафтордифенилдисульфида в соотношении 4 : 1. При этом выход арена 1 достигает 42% [9]. Как оказалось, тиол 6 с бромом при 400°C дает соединение 4 с выходом 69%. Схема процесса образования соединения 4 аналогична предложенной в работе [9].
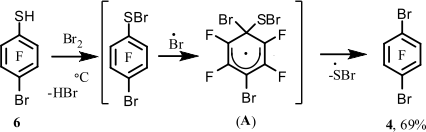
Более высокий выход соединения 4 по сравнению с выходом арена 1 при 400°C может свидетельствовать о более высокой реакционной способности тиола 6 по сравнению с тиолом 5.
Подобный результат получен и при пиролизе эквимолярной смеси тиолов 5 и 6 с недостатком брома; при этом образуется смесь аренов 1 и 4 в мольном соотношении ~1 : 1.8 согласно данным ЯМР 19F.
Большая реакционная способность тиола 6 по сравнению с тиолом 5 в близких условиях возможно объясняется большей стабильностью промежуточного радикального σ-комплекса (А), образованного из тиола 6, по сравнению с σ-комплексом (B), образованным из тиола 5.
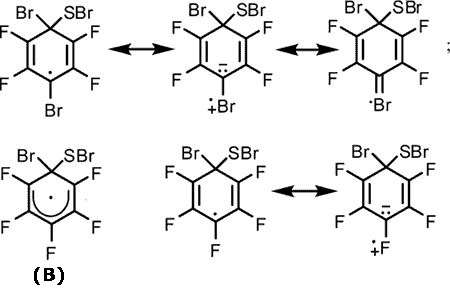
Стабильность радикального σ-комплекса (А) возрастает видимо за счет участия атома
брома в делокализации неспаренного электрона. Известно, например, что α-атомы хлора более эффективно
стабилизируют радикал, чем α-атомы фтора [11].
Ранее 1,4-дихлортетрафторбензол (7)
нами был использован для получения 1,2,4-трифтортрихлорбензола путем превращения арена 7 в 2,5-дихлортрифторбензолтиол и последующим пиролизом последнего в присутствии хлора при ~400°C
[12].
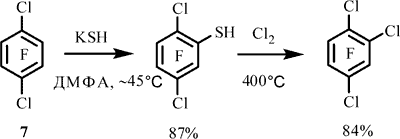
Нам казалось целесообразным использовать подобный подход для синтеза соединения 2 из арена 4. Однако, реакция последнего с KSH происходит сложным путем в отличие от реакции арена 7 с KSH и дает смесь различных соединений.
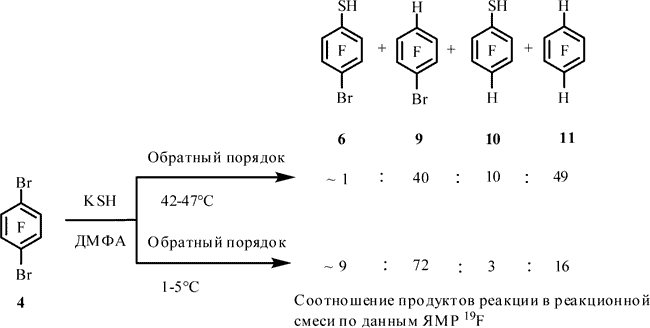
Попытка введения тиольной группы в арен 4 с целью получения 2,5-дибромтрифторбензолтиола (8), в условиях, близких к аналогичной реакции арена 7 с KSH [12], привела к образованию преимущественно 1-бром-2,3,5,6-тетрафторбензола (9), наряду с очень небольшими количествами 2,3,5,6-тетрафторбензолтиола (10) и следовыми количествами тиола 6 и 1,2,4,5-тетрафторбензола (11). При этом тиол 8, согласно данным ЯМР 19F и 1H и хроматомасс-спектрометрии, не образуется (Табл.1,оп.1). Образование известных соединений 6, 9, 10 и 11 подтверждено с помощью спектров ЯМР 19F и 1H [9, 10,13], а также данными хроматомасс-спектрометрии.
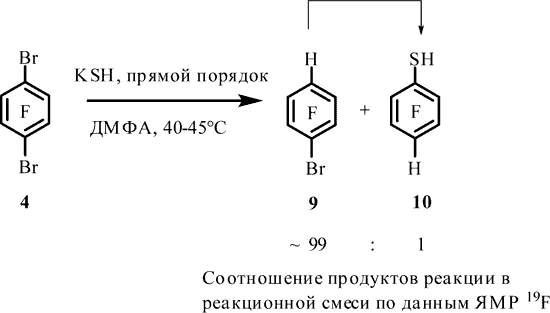
Снижение температуры реакции до 1-5°C не изменило основной результат реакции. При этом наряду с соединениями 9, 6, 10, 11 по данным ЯМР 19F, 1H и хроматомасс-спектрометрии зафиксировано образование тиола 8. Соотношение соединений 9 : 6 : 10 : 11 : 8 составляет ~78 : 13 : 3 : 2 : 4 (по данным ЯМР 19F) (Табл. 1, оп. 2).
Раннее было показано, что в реакции соединения 9 с KSH получался тиол 10 [10].
При обратном порядке смешения реагентов, при 42-47°C происходит образование преимущественно соединения 11, наряду со значительным количеством 9; в смеси также содержится тиол 10 и незначительное количество тиола 6 (Табл. 1, оп. 3). При 1-5°C основным продуктом реакции становится соединение 9, а содержание арена 11 снижается, наряду с возрастанием содержания тиола 6; образование соединения 10 наблюдается в незначительных количествах (Табл. 1, оп. 4).
Можно предположить, что соединения 9 и 11 получаются как результат галогенофильной реакции [10,14, 15,16,17], а 6 и 10 – как результат нуклеофильной реакции -SH по связи C-Br соединений 4 и 9 [10, 18].
Было показано, что при проведении реакции арена 4 с KSH с добавкой азобензола в качестве ингибитора радикально-цепного процесса [19, 20], при прямом и обратном порядке смешения реагентов при ~45°C значительного изменения соотношения продуктов не наблюдается. Для прямого порядка смешения реагентов соотношение соединений 9 : 6 : 10 : 11 составляет ~91 : 2 : 3 : 4 (Табл. 1, оп. 5), для обратного порядка смешения реагентов – 9 : 6 : 10 : 11 ~30 : 1 : 9 : 60 соответственно (по данным ЯМР 19F) (Табл. 1, оп. 6), что может свидетельствовать в пользу галогенофильного механизма образования соединений 9 и 11.
Экспериментальная часть
Спектры ЯМР 19F и 1H записаны на приборе Bruker AV–300 (282.4 МГц для 19F, 300 МГц для 1H) в CCl4 c добавкой (CD3)2СO. Положительные значения химических сдвигов соответствуют смещению сигнала в слабое поле от С6F6 и ТМС, внутренние стандарты - С6F6 и ГМДС (0.04 м.д. от ТМС). Для хроматомасс-спектрометрии (ГХ-МС) использовали хроматограф с масс-селективным детектором HP G1801A. Энергия ионизирующих электронов 70 эВ. Разделение веществ осуществляли с помощью 30-метровой колонки с внутренним диаметром 0.25 мм, покрытой пленкой сополимера HP-5 толщиной 0.25 мкм, газ-носитель – гелий, скорость потока 1 мл/мин, температура колонки 50-280°С, температура источника ионов 173°С. ГЖХ анализ проводили на приборе Hewlett Packard HP 5980, снабженном кварцевой капиллярной колонкой HP-5 (неподвижная фаза – диметилдифенилполисилоксан), 30 м × 0.52 мм / 2.6 мкм и детектором по теплопроводности.
Идентификация соединений 8, 9, 10 и 11 а также 1 и 4 проводилась по спектрам ЯМР 19F и 1H реакционных смесей и с помощью ГХ-МС.
Исходный тиол 6 был получен по методике, приведенной в [10]. Очищали тиол 6 перегонкой в вакууме (7-8 мм рт. ст.) и последующей перекристаллизацией из гексана. Спектр ЯМР 19F, δ, м.д.: 26.0 м (F2,6), 29.0 м (F3,5). Спектр ЯМР 1H, δ, м.д.: 3.98 с (SH) [10 ].
1,4-Дибромтетрафторбензол (4). Реакцию пиролиза тиола 6 в присутствии брома при 400°C проводили в кварцевой трубке (реактор размерами 400 х 20 мм), нагреваемой в электрической трубчатой печи. Перед началом подачи систему предварительно продували аргоном. Подача брома и полифторбензолтиола 6 в реактор осуществлялась из отдельных капельных воронок в токе аргона (~3 л/ч). 3.87 г (14.83 ммоль) тиола 6 предварительно расплавляли и подавали одновременно с 8.38 г (52.44 ммоль) Br2 в течение 8.3 мин. Продукты бромирования собирали в приемник, охлаждаемый ледяной водой. Далее реакционную массу доводили до комнатной температуры, затем обрабатывали раствором сульфита натрия (17.21 г в 70 мл воды) для удаления брома, после этого перегоняли с паром. Твердый продукт отделяли фильтрованием и сушили над CaCl2. Получено 3.16 г. Содержание арена 6 по ГЖХ - 99%. Спектр ЯМР 19F, δ, м.д.: 30.6 с [21].
Пиролиз смеси тиолов 5 и 6 в присутствии недостатка брома. Реакцию пиролиза смеси тиолов 5 и 6 в присутствии брома при 400°C проводили по методике, описанной выше. Смесь тиолов 5 0.98 г (4.90 ммоль) и 6 1.30 г (4.98 ммоль) предварительно расплавляли и подавали одновременно с 0.91 г (5.69 ммоль) Br2 в течение 2.8 мин. Реакционную смесь собирали и обрабатывали раствором сульфита натрия (5.10 г в 50 мл воды). Продукт отделяли от воды декантацией и сушили над CaCl2. Получено 2.14 г. Мольное соотношение аренов 1 и 4 составило ~1 : 1.8 по данным ЯМР 19F. По данным ГХ-МС продукт содержит также декафтор-, бромнонафтор- и дибромоктафтордифенилдисульфиды.
Взаимодействие 1,4-дибромтетрафторбензола (4) с гидросульфидом калия (типовой эксперимент)
При прямом порядке смешения реагентов соединение 4 растворяли в ДМФА и к этому раствору при перемешивании прибавляли раствор KSH в этиленгликоле (концентрация раствора составляет ~4-4.2 моль/л). При обратном порядке смешения реагентов соединение 4 растворяли в 5 мл ДМФА и добавляли к раствору KSH, разбавленному ДМФА. При смешении реагентов реакционная смесь начинала самопроизвольно разогреваться. При необходимости температуру реакционной смеси, указанную в таблице 1, поддерживают, помещая колбу в охлаждающую баню. Время смешения реагентов и происходящее при этом изменение температуры реакционной смеси указаны в графе "смешение реагентов". Далее реакционную массу перемешивали в течение времени, указанном в графе "выдержка". Затем реакционную массу выливали в смесь 15 мл концентрированной соляной кислоты и 20-25 г льда, доводили до комнатной температуры и затем перегоняли с паром. Органический слой отделяли, сушили CaCl2 и анализировали методами ЯМР 19F и 1H, ГХ-МС и ГЖХ.
Таблица 1. Взаимодействие 1,4-дибромтетрафторбензола (4) с гидросульфидом калия
|
№ опыта |
Взято для реакции |
Время (мин)/ |
Выход смеси, г |
|||
|
соединение 4, г (ммоль) |
ДМФА, мл |
KSH, мл |
смешение реагентов |
выдержка |
||
|
11 |
1.04 (3.38) |
10 |
1.7 |
5.7/40-45 |
120/42-45 |
0.61 |
|
21 |
1.20 (3.90) |
11 |
2.0 |
5.6/1-5 |
180/1-5 |
0.71 |
|
32 |
1.45 (4.71) |
5+10 |
2.2 |
5.8/42-45 |
135/42-47 |
0.74 |
|
42 |
1.31 (4.26) |
5+9 |
2.0 |
5.7/1-5 |
190/2-5 |
0.70 |
|
51а |
1.08 (3.51) |
10 |
1.8 |
5.1/42-47 |
130/44-47 |
0.65 |
|
62а |
1.10 (3.57) |
4+8 |
1.8 |
5.6/41-48 |
130/46-48 |
0.64 |
1 прямой порядок смешения
2обратный порядок смешения
aс
добавкой азобензола (4 : PhN2Ph ~ 1 : 0.4)
2,5–Дибромтрифторбензолтиол (8). Спектр ЯМР 19F, δ, м.д.: 32.7 д.д (F4, JF4-F3 22 Гц, JF4-F61.7 Гц), 34.1 д.д.д (F3,JF3-F4 22 Гц,JF3-F6 11 Гц, JF3-H 1.5 Гц), 61.3 д.д.д (F6, JF6-F3 11 Гц, JF6-H 2.5 Гц,JF6-F4, 1.7 Гц). Спектр ЯМР 1H, δ, м.д.: 4.30 д.д (SH, JH-F6 2.5 Гц,JH-F3 1.5 Гц). Найдено: [M]+ 320, 2 атома брома. Вычислено, M 320.
1-Бром-2,3,5,6-тетрафторбензол (9). Спектр ЯМР 19F, δ, м.д.: 24.9 м (F3,5), 29.2 м (F2,6). Спектр ЯМР 1H, δ, м.д.: 7.25 т.т (H4, JH-F3,5 9.5 Гц, JH-F2,6 7.5 Гц) [9].
2,3,5,6-Тетрафторбензолтиол (10). Спектр ЯМР 19F, δ, м.д.: 23.5 м, 24.4 м. Спектр ЯМР 1H, δ, м.д.: 3.91 с (SH), 6.92 т.т (H4, JH-F3,5 9.5 Гц,JH-F2,6 7.5 Гц) [10].
1,2,4,5-Тетрафторбензол (11). Спектр ЯМР 19F, δ, м.д.: 23.5 м. Спектр ЯМР 1H, δ, м.д.: 7.15 м [13 ].
Работа выполнена при финансовой поддержке Президиума Сибирского отделения Российской академии наук (Междисциплинарный ИП № 57).
Список литературы:
- Синтезы фторорганических соединений / Под ред. И.Л. Кнунянца, Г.Г. Якобсона. М.: Химия, 1973. 312 с.
- Фторполимеры / Под ред. И.Л.Кнунянца, В.А. Пономаренко. М.: Мир, 1975. 448 с.
- Pummer W.J., Wall L.A. Reactions of pentafluorohalobenzenes // J. Res. Nat. Bur. Stand. 1959. V. 63a. № 2. P. 167-169.
- Nield E., Stephens R., Tatlow J.C. Fluorocyclohexanes. Part VI. Some hexa- and pentafluorocyclohexenes and their dehydrofluorination // J. Chem. Soc. 1960. № 10. P. 3800-3806.
- Burdon J., King D.R., Tatlow J.C. Aromatic polyfluoro compounds–XXXIV. Nucleophilic replacement reactions of some tetrafluorohalogenobenzenes // Tetrahedron. 1966. V. 22. № 8. P. 2541-2549.
- Hellmann M., Bilbo A.J. The preparation of two fluorinated p-dihalobenzenes // J. Am. Chem. Soc. 1953. V. 75. № 18. P. 4590-4591.
- Якобсон Г.Г., Платонов В.Е., Ворожцов-мл. Н.Н. Ароматические фторпроизводные. XVI. Получение гексафторбензола и полифторхлорпроизводных бензола // ЖОХ. 1965. Т. 35. № 7. C. 1158-1161.
- Рахимов А.И. Химия и технология фторорганических соединений. М.: Химия, 1986. 271 с.
- Платонов В.Е., Максимов А.М., Дворникова К.В., Никульшин П.В. Фторорганические серосодержащие соединения. V. Сопиролиз полифторарентиолов, -гетарентиолов и их производных с хлором и бромом // ЖОрХ. 2005. Т. 41. Вып. 11. С. 1681–1687.
- Maksimov A.M., Platonov V.E. Reactions of some polyfluoroaromatic compounds with potassium hydrosulfide // Fluorine Notes: сетевой журн.1999. N. 4 .URL: /contents/history/1999/4_1999/letters/index.html (дата обращения: 08.11.2010).
- Нонхибел Д., Уолтон Дж. Химия свободных радикалов. М.: Мир, 1977. 606 с.
- Платонов В.Е., Максимов А.М., Никульшин П.В. Синтезы 1,2,4-трихлортрифторбензола, 2,4,5-трихлор-3,6-дифторфенола и –тиофенола - базовых соединений для создания новых фторсодержащих пестицидов // II конференция «Фундаментальная наука в интересах развития химической и химико-фармацевтической промышленности», Пермь (Россия). 2004. Тезисы докладов, С. 209.
- Gierczyk B., Wojciechowski G., Brzezinski B., Grech E., Schroeder G. Study of the decarboxylation mechanism of fluorobenzoic acids by strong N-bases // J. Phys. Org. Chem. 2001. V. 14. № 10 P. 691-696.
- Bolton R., Sandall J.P.B. Proto-debromination of some polybromopolyfluorobenzenes // J. Fluor. Chem. 1976. V. 7. № 5. P. 540-542.
- Bolton R., Sandall J.P.B. Nucleophilic displacement in polyhalogenaromatic compounds. Part 2. Kinetics of halogen displacement from bromopolyfluoroaromatic compounds // J. Chem. Soc., PT II. 1976. № 13. P. 1545-1548.
- Montanari S., Paradisi C., Scorrano G. Thiol anions in nucleophilic aromatic substitution reactions with activated aryl halides. Attack on carbon vs attack on halogen // J. Org. Chem. 1993. V. 58. № 21. P. 5628-5631.
- Zefirov N.S., Makhon'kov D.J. X-Philic reactions // Chem. Rev. 1982. V. 82. № 6. P. 615-624.
- Christopher J.A., Brophy L., Lynn S.M., Miller D.D., Sloan L.A., Sandford G. Synthetic utility of 4-bromo-2,3,5,6-tetrafluoropyridine // J. Fluor. Chem. 2008. V. 129. № 5. P. 447-454.
- Zoltewicz J.A., Oestreich T.M. Heteroaromatic nucleophilic substitution. Inducing a change from an ionic to a radical-chain mechanism with methoxide ion // J. Am. Chem. Soc. 1973. V. 95. № 20. P. 6863-6864.
- Swartz J.E., Bunnett J.F. Reactions of halotoluenes with potassium diphenylphosphide. Evidence for a thermally induced aromatic SRN1 reaction // J. Org. Chem. 1979. V. 44. № 3. P. 340-346.
- Geramita K., Tao Y., Segalman R.A., Tilley T.D. Synthesis and characterization of fluorinated heterofluorene-containing donor–acceptor systems //J. Org. Chem. 2010. V. 75. № 6. P. 1871-1887.
Материал рекомендован к публикации членом редколлегии В.Е. Платоновым
Fluorine Notes, 2011, 75, 5-6
