Received: апрель 2016
DOI 542.913-977:[547.569.1:546.16]:547.539.3
Fluorine Notes, 2016, 106, 1-2
СИНТЕЗ БРОМПОЛИФТОРАРЕНОВ ИЗ ПОЛИФТОРАРЕНТИОЛОВ С PBr5 И Br2
П.В.Никульшин, А.М.Максимов, В.Е.Платонов@
Федеральное
государственное бюджетное учреждение науки Новосибирский институт
органической химии им. Н.Н. Ворожцова Сибирского отделения Российской
академии наук, Российская Федерация, 630090, г. Новосибирск 90, просп. Академика Лаврентьева,
д. 9,
E-mail : platonov@nioch.nsc.ru
Аннотация: Взаимодействием полифторарентиолов с PBr5 и Br2при 150-240°C в ампулах и с Br2 в проточной системе при 350-650°C осуществлены реакции замены тиольной группы на атом брома и синтезирован ряд бромполифтораренов, в том числе содержащих одновременно атомы хлора и брома в орто- и пара-положениях.
Ключевые слова: бром, тиольная группа,полифторарентиолы, бромполифторарены.
Ранее нами был разработан метод введения атомов хлора и брома в полифторарены путём термической замены легко и селективно вводимой в полифторарен с помощью реакций нуклеофильного замещения тиольной группы [1] на атом хлора и брома [2, 3]. Данный процесс происходит при высоких температурах (400-500°C) в проточной системе и приводит к получению ряда хлор- и бромполифторароматических соединений с высокими выходами [2, 3]. При использовании PCl5 в качестве источника хлора замена тиольной группы в полифторарентиолах на атом хлора была реализована при более низкой температуре (200-220°C, реакции в ампулах) [4]. В этой связи представляло интерес осуществить подобные превращения полифторарентиолов с PBr5 и Br2.
Нами показано, что при нагревании полифторарентиолов с PBr5 или Br2 в ампулах при ~220°C происходит замена тиольной группы на атом брома. Так, из пентафторбензолтиола 1 и PBr5 (мольное соотношение 1 : 2) при ~220°C в течение 8 часов с хорошим выходом получен бромпентафторбензол (2) (схема 1). Вместо PBr5 в реакции с пентафторбензолтиолом (1) может быть использован Br2. При нагревании тиола 1 с Br2 (мольное соотношение ~1 : 4.5) при ~220°C в течение 8 часов образуется арен 2 и декафтордифенилдисульфид (3) (~84 : 16 по данным ЯМР 19F). Увеличение времени реакции до 16 часов позволило получить с высоким выходом соединение 2 (схема 1).
Схема 1
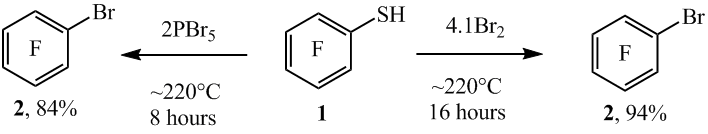
Уменьшение количества Br2 до 2 молей и времени реакции до 5 часов привело к образованию арена 2 и дисульфида 3 с выходами 44% и 48% соответственно (данные ГЖХ, схема 2). В аналогичных условиях при взаимодействии тиола 1 с PBr5 (мольное соотношение ~1 : 2) или PBr3 + Br2 (мольное соотношение ~1 : 2 : 2) образуется соединение 2, содержащее небольшие количества дисульфида 3 (ЯМР 19F и ГЖХ). В реакции тиола 1 с PBr3 (мольное соотношение ~1 : 2) образуется лишь соединение 3.
Схема 2
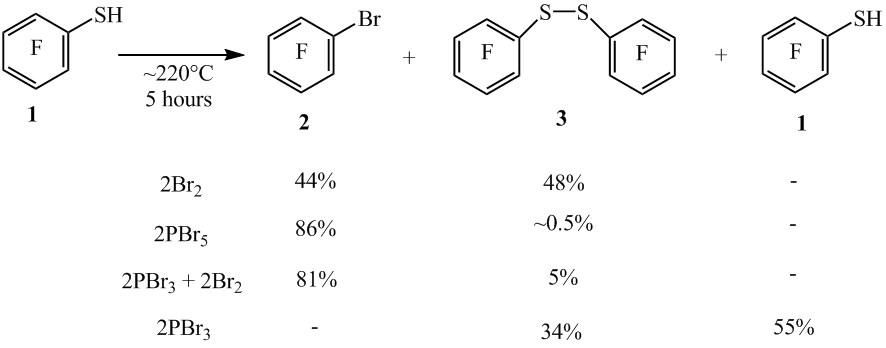
Увеличение времени реакции 1 с Br2 (мольное соотношение ~1 : 2) до 8 и 16 часов показало, что реакция протекает не полностью и реакционные смеси содержали дисульфид 3 (схема 3). Увеличение времени реакции до 22 часов позволило получить арен 2 с выходом 89%.
Схема 3

В реакции тиола 1 с Br2 при их мольном соотношении ~1 : 3 при ~220°C в течение 16 часов выход соединения 2 составил 91%. Как уже было сказано выше, в близких условиях из тиола 1 и Br2 (мольное соотношение ~1 : 4.1) соединение 2 было получено с выходом 94%. И хотя величины выходов целевого продукта в этих реакциях отличаются на небольшую величину, нами для дальнейших превращений полифторарентиолов с бромом было выбрано их мольное соотношение ~1 : 4-4.3 с целью достижения максимально высоких выходов конечных продуктов.
При увеличении температуры реакции соединения 1 с Br2 (мольное соотношение ~1 : 4.1) до ~250°C (16 часов) арен 2 получается наряду с небольшой примесью полибромполифторбензолов, согласно данным ЯМР 19F, ГХ-МС и ГЖХ (табл. 1, оп. 7). Ранее при сопиролизе C6F6 с Br2 при ~770°C происходило образование арена 2 и полибромполифторбензолов [5]. В этой связи температура ~220°C является приемлемой для проведения процесса бромирования соединения 1 и его производных.
При нагревании дисульфида 3 с бромом при ~220°C также образуется арен 2 с высоким выходом (схема 4).
Схема 4
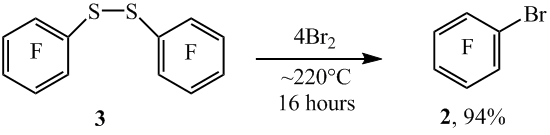
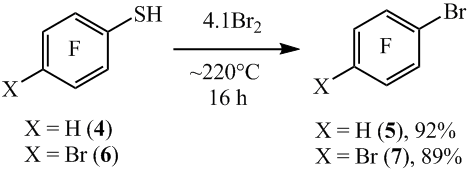
В случае пара-замещенных тиола 1 тиольная группа также гладко замещается на бром. Так, нагреванием 2,3,5,6-тетрафторбензолтиола (4) с бромом при ~220°C получен 1-бром-2,3,5,6-тетрафторбензол (5). При этом связь C-H остается непрореагировавшей. Аналогично из 4-бромтетрафторбензолтиола (6) получен 1,4-дибромтетрафторбензол (7) (схема 5).
Схема 5
При нагревании 4-хлор-2,3,5,6-тетрафторбензолтиола (8) с бромом при ~200°C наряду с 1-бром-2,3,5,6-тетрафтор-4-хлорбензолом (9) в качестве побочного продукта образуется арен 7 (схема 6) вследствие частичной замены атома хлора на бром. Снижение температуры реакции до ~185°C позволило понизить содержание соединения 7 (схема 6).
Схема 6
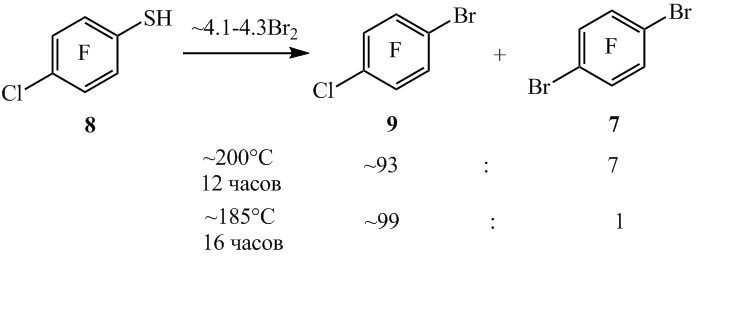
мольное соотношение продуктов реакции в реакционной смеси, рассчитанное по данным ГЖХ
Нами проведены реакции сопиролиза тиола 8 с Br2 в проточной системе при различных температурах. При 350°C из тиола 8 и Br2 получен арен 9 с меньшим выходом и с примесью соединения 7. При этом наблюдалась неполная конверсия (~60%) тиола 8 (схема 7) (табл. 2, оп. 1). С увеличением температуры сопиролиза до 450°C увеличивается образование соединения 7, а при 550°C соединение 7 становится основным продуктом реакции (табл. 2, оп. 3). Повышение температуры сопиролиза до 650°С приводит к осмолению и снижению выхода реакционной смеси (табл. 2, оп. 4).
Схема 7
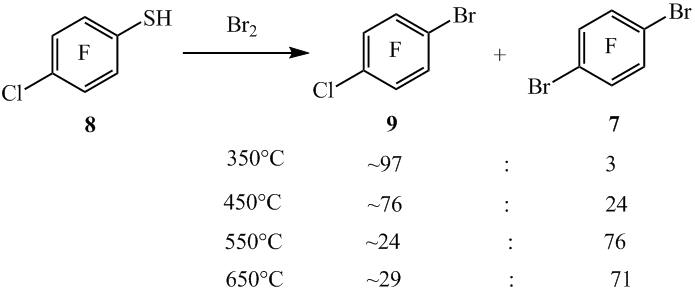
мольное соотношение продуктов реакции в реакционной смеси, рассчитанное по данным ГЖХ
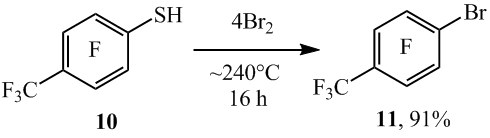
Из 4-трифторметил-2,3,5,6-тетрафторбензолтиола (10) и брома в ампуле с высоким выходом получен 4-бромгептафтортолуол (11) (схема 8).
Схема 8
Аналогично из 5-нонафториндантиола (12) и 6-бромоктафториндан-5-тиола (13) с высокими выходами синтезированы 5-бромнонафториндан (14) и 5,6-дибромоктафториндан (15) соответственно (схема 9).
Схема 9
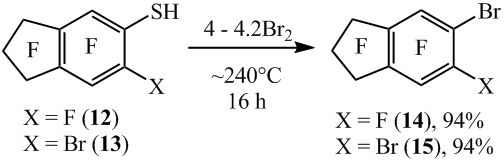
Стоит отметить, что соединение 15 может быть получено в проточном реакторе из тиола 13 и Br2 с выходом 85% (схема 10).
Схема 10
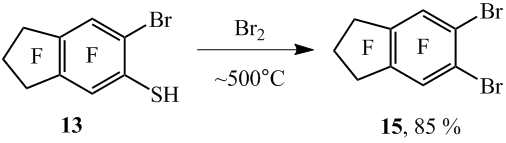
В ампулах варьированием времени и температуры реакции удаётся синтезировать полифторарены, содержащие в орто-положении атомы хлора и брома. Так, при нагревании 2,4,5-трифтор-3,6-дихлорбензолтиола (16) и 2,5-дифтор-3,4,6-трихлор-бензолтиола (17) с бромом были получены 1-бром-2,4,5-трифтор-3,6-дихлорбензол (18) и 1-бром-2,5-дифтор-3,4,6-трихлорбензол (19) (схема 11). При этом в качестве побочных продуктов наблюдалось образование в небольших количествах дибромпроизводных согласно данным ЯМР 19F, ГХ-МС и ГЖХ.
Схема 11
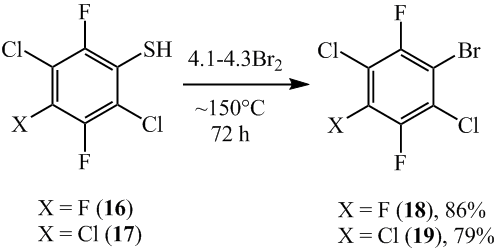
Аналогично, при бромировании 6-хлороктафториндан-5-тиола (20) был получен 5-бромоктафтор-6-хлориндан (21) (схема 12), при этом образование соединения 15 согласно данным ЯМР 19F, ГХ-МС и ГЖХ практически не наблюдалось.
Схема 12
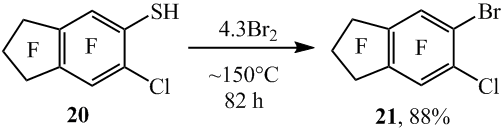
Замена тиольной группы на атом брома в полифторарентиолах возможно происходит по гомолитическому механизму аналогично замене тиольной группы на атом хлора при сопиролизе полифторарентиолов с хлором [2]. В качестве промежуточных продуктов в реакции полифторарентиолов с бромом могли бы образовываться полифтораренсульфенилбромиды [6] наряду с бис(полифторарен)дисульфидами. По аналогии с превращением дисульфида 3 под действием Cl2 в пентафторбензолсульфенилхлорид [2] видимо не исключается и превращение бис(полифторарен)дисульфидов под действием брома в промежуточные на пути к бромполифторарену полифтораренсульфенилбромиды. Например, взаимодействие пентафторбензолсульфенилбромида (22) с атомом брома с промежуточным образованием радикального σ-комплекса (А) и последующим элиминированием серосодержащей функции вероятно приводит к образованию арена 2 (схема 13).
Схема 13
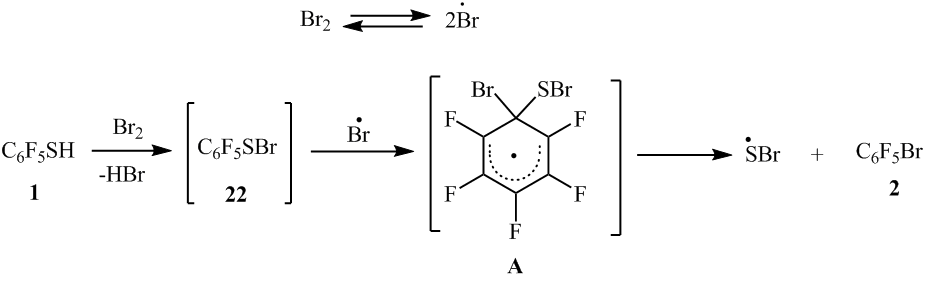
Замена атомов хлора на бром в реакциях хлорполифторарентиолов с Br2 видимо также происходит по гомолитическому механизму (схема 14). При этом замена тиольной группы на бром происходит легче, чем хлора на бром.
Схема 14
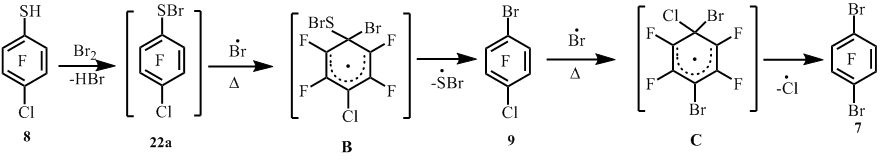
Можно полагать, что в радикальном σ-комплексе (Б) связь C-S более слабая, чем C-Br (энергии связи C-S, E=52 ккал/моль, C-Br, E=58 ккал/моль [7]), и поэтому происходит элиминирование серосодержащей функции. В случае образования радикального σ-комплекса (C) для замены более прочной связи C-Cl (E=93.8 ккал/моль [7]) требуется более высокая температура (450-550ºC). Вероятно, что в реакции соединения 8 с бромом лимитирующей стадией превращения сульфенилбромида 22a в соединение 9 под действием атома брома является стадия образования радикального σ-комплекса (B), а в случае образования радикального σ-комплекса (C) лимитирующая стадия – вторая с элиминированием атома хлора (схема 14).
В какой-то мере, видимо, не может быть исключена замена атома хлора на бром в соединении 8, с последующим замещением тиольной группы на атом брома в промежуточном тиоле 6. Этот вопрос требует отдельного исследования.
Для реакции тиола 1 с PBr5, принимая во внимание, что в кристаллическом состоянии PBr5 имеет ионную структуру [PBr4]+Br– [8], при участии катиона [PBr4]+ могло бы происходить образование сульфенилбромида 22, который, взаимодействуя с тиолом 1, превращается в дисульфид 3 (схема 15). Образование дисульфида 3 из тиола 1 и PBr5 без участия сульфенилбромида 22, видимо, также не исключается. Дисульфид 3 под действием PBr5 мог бы переходить в сульфенилбромид 22, аналогично превращению данного дисульфида 3 в пентафторсульфенилхлорид в реакции с PCl5 [4].
Схема 15
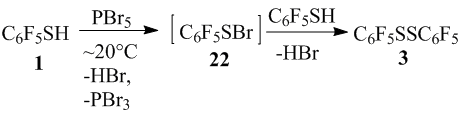
Известно, что PBr5 кипит с разложением при 106ºC [9] и таким образом является источником брома. Согласно оценке, проведённой нами по аналогии с таковой для PCl5 [10], энергия аксиальной связи P-Br в тригональной бипирамиде PBr5 [11] составляет 28 ккал/моль [10], тогда как энергия связи Br-Br является более высокой величиной (45.4 ккал/моль [7]). Учитывая эти данные, можно предположить, что вначале PBr5 распадается с образованием атома брома и радикала •PBr4 (схема 16, уравнение 1). Последний также может распадаться с образованием PBr3 и •Br (уравнение 2). Далее взаимодействие, например, сульфенилбромида 22 с атомом брома вероятно даёт радикальный σ-комплекс (А) [2], при распаде которого образуется соединение 2 (уравнение 5). Радикал •SBr, элиминирующийся при распаде σ-комплекса (А), взаимодействуя с PBr3, мог бы образовывать фосфоранильный радикал (D). Последний при β-распаде даёт зафиксированный нами с помощью спектра ЯМР 31P и хромато-масс-спектрометрии тиофосфорилбромид 23. Известно, что фосфоранильные радикалы, хотя и являются относительно стабильными, могут претерпевать β-распад, в том числе с образованием S=P связи [12].
Схема 16
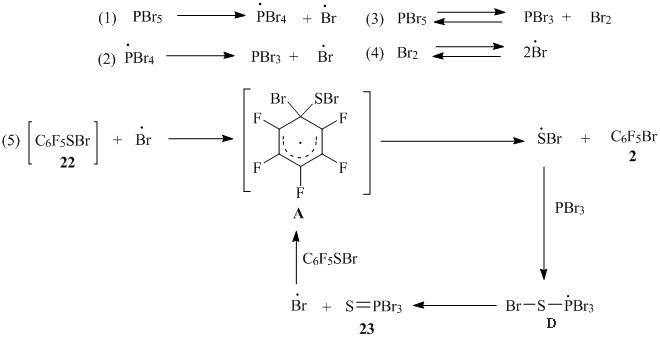
Поскольку энергия аксиальной связи P-Br в PBr5 меньше энергии связи Br-Br, то можно полагать, что PBr5 является более эффективным источником атомарного брома, чем Br2 что, по-видимому, объясняет меньшее время, необходимое для протекания реакции тиола 1 с PBr5, чем с Br2.
На схеме 16, кроме уравнений 1 и 2, приведено образование Br2 из PBr5 и диссоциация Br2 на атомы брома (уравнения 3, 4) по аналогии с превращением PCl5 [4]. Такое направление распада PBr5 видимо исключать нецелесообразно.
Энергия аксиальной связи P-Cl в тригональной бипирамиде PCl5 [11] составляет 34 ккал/моль [10], тогда как энергии связи Cl-Cl - более высокая величина (57.2 ккал/моль [7]). В этой связи могло бы происходить изменение реакционной способности соединения 1 по отношению к PCl5 [4] и Cl2 в пользу процесса с PCl5. Однако, нами этот вопрос экспериментально не исследовался.
Экспериментальная часть
Аналитические и спектральные измерения были выполнены в Химическом сервисном центре коллективного пользования СО РАН.
Спектры ЯМР 31P, 19F и 1H записывали на приборе Bruker AV–300 (121 МГц для 31P, 282 МГц для 19F, 300 МГц для 1H) в CCl4 c добавкой CDCl3. Для ЯМР 31P внешний стандарт – H3PO4. Для спектров ЯМР 19F и 1H внутренние стандарты - С6F6 и ГМДС (0.04 м.д. от ТМС) соответственно. Положительные значения химических сдвигов соответствуют смещению сигнала в слабое поле. ИК-спектры получали на приборе Bruker Vector 22 IR. УФ-спектры записывали на приборах Hewlett Packard 8453 UV и Cary 5000. Молекулярные массы и элементный состав определяли масс-спектрометрически на приборе DFS (номинальная энергия ионизации 70 эВ). Для ГХ-МС использовали хроматограф HP 5890 с масс-селективным детектором HP 5971 и хроматограф Agilent 6890N с системой Agilent 5973N. Энергия ионизирующих электронов 70 эВ. Разделение веществ осуществляли с помощью колонки HP-5, 30 м × 0.25 мм × 0.25 мкм, газ-носитель – гелий, скорость потока 1 мл/мин, температура колонки 50–280°С, источника ионов 173°С. ГЖХ анализ проводили на приборе HP 5890 c колонкой HP-5, 30 м × 0.52 мм × 2.6 мкм и детектором по теплопроводности.
Исходные тиолы были получены по методике, приведенной в [13].
Раствор KSH в этиленгликоле (~4.1 моль/л) получали пропусканием сероводорода в раствор 2 моль KOH в 330 мл этиленгликоля до увеличения массы на 64 г.
Получение 6-бромоктафториндан-5-тиола (13). К раствору 50.35 г (140.26 ммоль) индана 14 в 100 мл изопропилового спирта, при охлаждении смесью воды со льдом, при перемешивании прибавляли в течение 1.5 часов 71 мл раствора KSH в этиленгликоле, при температуре не выше 5оС. Далее реакционную массу перемешивали 2.5 часа, поддерживая температуру в интервале 0-1оС, затем выливали в смесь 350 мл соляной кислоты и 500 г льда. Осадок отфильтровывали, сушили над CaCl2. Масса сухого продукта 48.95 г. Анализировали методом ЯМР 19F, 1Н и ГЖХ. Содержание соединения 13 по ГЖХ - 98% (выход 91%). Т. пл. 32-33.5°C (пентан). Спектр ЯМР 19F, δ, м.д, : 31.9 квинт (2-CF2, J2-CF2–1,3-CF2 4.5 Гц), 51.2 д.т (F4, JF4-F7 21 Гц, JF4–3-CF2 7.5 Гц), 53.7 уширенный мультиплет (1(3)-CF2), 53.9 д.т (F7, JF7-F4 21 Гц, JF7–1-CF2 7.5 Гц), 54.7 уширенный мультиплет (1(3)-CF2). Спектр ЯМР 1H, δ, м.д.: 4.56 с. УФ-спектр (гексан), λмакс, нм (lgε,): 223 (4.19), 262 (3.82), 288 (3.18), 297 (3.21). ИК спектр (KBr), ν, см-1: 2587, 2568, 1627, 1455, 1298, 1247, 1204, 1154, 1096, 1060, 955, 944, 869, 804, 576, 543. Найдено, %: С 28.84; H 0.24; F 40.71; S 8.76; Br 21.25. M+ 371.8854. C9HBrF8S. Вычислено, %:C, 28.98; H, 0.27; F, 40.74; S, 8.60; Br, 21.42. М+ 371.8849.
Реакции тиола 1 с PBr5. В ампулу помещали 2.27 г (11.34 ммоль) тиола 1 и порциями добавляли 10.13 г (23.53 ммоль) PBr5. По окончании выделения газа, ампулу запаивали. Ампулу помещали в металлический кожух и нагревали при 218-220ºC в течение 5 часов. По окончании реакции ампулу охлаждали с помощью жидкого азота, вскрывали. Получено 11.49 г реакционной массы, содержащей по данным ГХ-МС 46% соединения 2 и 50% Br3PS 23. Далее содержимое переносили в колбу под слой воды со льдом (~60 г). Смесь перемешивали 2 часа на магнитной мешалке с целью гидролиза соединений фосфора, затем подщелачивали Na2CO3 и перемешивали еще 2 часа, перегоняли с паром. Продукт (2.44 г) отделяли, сушили CaCl2 и анализировали методами ЯМР 19F и ГЖХ. Содержание соединения 2 - 98.3% (по данным ГЖХ) и дисульфида 3 - 0.5% (по данным ГЖХ).
Идентификацию соединения 23 проводили по спектру ЯМР 31P (δ, м.д: -115.3 с [14]), а также с помощью ГХ-МС. Полный масс-спектр соединения 23: 306 (15.1), 304 (42.3), 302 (42.2), 300 (14.6; Br3PS), 225 (52.8), 223 (100), 221 (51.0; Br2PS), 193 (3.7), 191 (7.4), 189 (3.7; Br2P), 112 (6.4), 110 (6.5; BrP), 81 (6.6), 79 (6.7; Br), 63 (26.0; PS), 32 (1.5; S), 31 (3.0; P).
Аналогично из 2.12 г (10.59 ммоль) тиола 1 и 89.14 г (21.23 ммоль) PBr5 (218-220ºC, 8 часов) получили 2.21 реакционной массы с содержанием соединения 2 - 99.1% по данным ГЖХ, выход 84%.
После смешения 0.09 г (0.45 ммоль) соединения 1 c 0.39 г (0.91 ммоль) PBr5 при комнатной температуре получили соединение 3 (данные ЯМР 19F) без образования других полифтораренов.
Реакция тиола 1 с PBr3 + Br2. Из 2.09 г (10.44 ммоль) соединения 1, 5.68 г (20.98 ммоль) PBr3 и 3.45 г (21.59 ммоль) Br2 (218-220ºC, 5 часов) получили 2.25 реакционной массы с содержанием соединения 2 - 93.1% (по данным ГЖХ) и дисульфида 3 - 4.4% (по данным ГЖХ).
Реакция тиола 1 с PBr3. Нагреванием 2.09 г (10.44 ммоль) тиола 1 и 5.77 г (21.32 ммоль) PBr3 (218-220ºC, 5 часов) получили 1.91 реакционной массы, содержащую исходный тиол 1 (60.1% по данным ГЖХ) и дисульфид 3 (37.0 % по данным ГЖХ).
Реакция тиола 1 с Br2. В ампулу помещали 0.17 г (0.85 ммоль) соединения 1 и порциями добавляли 0.61 г (3.80 ммоль) брома. По окончании выделения газа ампулу запаивали. Ампулу помещали в металлический кожух и нагревали при ~220°C 8 часов. По окончании реакции ампулу охлаждали, вскрывали, выливали в воду. Избыток брома удаляли с помощью сульфита натрия, экстрагировали ~2 мл хлористого метилена и анализировали с помощью ЯМР 19F (2 : 3 ~84 : 16 по данным ЯМР 19F).
Общая методика синтеза бромполифтораренов. В ампулу помещали полифторарентиол и порциями добавляли бром. По окончании выделения газа, ампулу запаивали, помещали в металлический кожух и нагревали. По окончании реакции ампулу охлаждали с помощью жидкого азота, вскрывали, содержимое переносили в колбу под слой воды (80-100 мл). Избыток брома удаляли с помощью сульфита натрия, после этого реакционную массу перегоняли с паром. Продукт отделяли, сушили CaCl2 и анализировали методами ЯМР 19F и ГЖХ. Аналогично проводили реакцию дисульфида 3 с бромом. Результаты приведены в таблице 1.
Образование соединений 2, 3, 4, 5, 7, 11 и 14 подтверждено спектрами ЯМР 19F [2, 3, 15].
Таблица 1
№ опыта |
Соединение, г (ммоль) |
Бром, (ммоль) |
Мольное соотношение тиола к Br2 |
Температура, °С |
Время, часы |
Выход смеси, г |
Содержание (выход) продукта по ГЖХ, % |
1 |
1, 2.01 (10.04) |
3.31 (20.71) |
2.06 |
218-220 |
5 |
2.05 |
2, 52.7А (44) |
2 |
1, 2.05 (10.24) |
3.39 (21.21) |
2.07 |
218-220 |
8 |
2.11 |
2, 72.7Б (61) |
3 |
1, 2.02 (10.09) |
3.32 (20.77) |
2.06 |
218-220 |
16 |
2.15 |
2, 91.5В (79) |
4 |
1, 2.10 (10.49) |
3.46 (21.65) |
2.06 |
218-220 |
22 |
2.32 |
2, 99.7 (89) |
5 |
1, 2.08(10.39) |
5.10 (31.91) |
3.07 |
218-220 |
16 |
2.34 |
2, 99.8 (91) |
6 |
1, 2.89 (14.44) |
9.51 (59.51) |
4.12 |
220-222 |
16 |
3.34 |
2, 99.9 (94) |
7 |
1, 2.76 (13.79) |
9.08 (56.82) |
4.12 |
250-255 |
16 |
3.18 |
2, 96.5Г (90) |
8 |
3, 3.11(7.81) |
5.11 (31.98) |
4.09 |
219-221 |
16 |
3.65 |
2, 99.8 (94) |
9 |
4, 2.76 (15.15) |
9.91 (62.01) |
4.09 |
218-220 |
16 |
3.21 |
5, 99.0 (92) |
10 |
6, 2.52 (9.65) |
6.30 (39.42) |
4.08 |
220-222 |
16 |
2.68 |
7, 98.7 (89) |
11 |
8, 3.49 (16.11) |
11.2 (69.83) |
4.33 |
201-203 |
12 |
4.00 |
9, 91.9Д (87) |
12 |
8, 3.46 (15.98) |
10.4 (65.02) |
4.07 |
185-187 |
16 |
3.41 |
9, 98.3Е (80) |
13 |
10, 3.33 (13.31) |
8.53 (53.38) |
4.01 |
238-240 |
16 |
3.61 |
11, 99.8 (91) |
14 |
12, 2.79 (8.94) |
6.02 (37.67) |
4.21 |
238-240 |
16 |
3.05 |
14, 98.5 (94) |
15 |
13, 2.73 (7.32) |
4.73 (29.60) |
4.04 |
238-240 |
16 |
2.90 |
15, 99.7 (94) |
16 |
16, 7.31 (31.37) |
20.09 (125.71) |
4.29 |
149-151 |
72 |
8.09 |
18, 93.5Ж (86) |
17 |
17, 3.54 (14.19) |
9.23 (57.57) |
4.07 |
149-151 |
72 |
3.63 |
19, 91.8З (79) |
18 |
20, 3.74 (11.38) |
7.79 (48.75) |
4.28 |
150-152 |
82 |
3.81 |
21, 98.3И (88) |
АСодержание дисульфида 3 в реакционной смеси составило 46.7% по данным ГЖХ. БСодержание дисульфида 3 в реакционной смеси составило 27.0% по данным ГЖХ. ВСодержание дисульфида 3 в реакционной смеси составило 7.9% по данным ГЖХ. ГПо данным ГХ-МС в реакционной смеси содержатся полибромполифторбензолы в количестве 3.4% (ГЖХ). ДПо данным ГХ-МС в реакционной смеси содержится арен 8 в количестве 8% (ГЖХ). ЕПо данным ГХ-МС в реакционной смеси содержится арен 8 в количестве 1.4% (ГЖХ). ЖПо данным ГХ-МС в реакционной смеси содержатся дибромтрифторхлорбензолы в количестве 2.5% (ГЖХ). ЗПо данным ГХ-МС в реакционной смеси содержатся дибромдифтордихлорбензолы в количестве 6.9% (ГЖХ). ИПо данным ГХ-МС в реакционной смеси содержится индан 15 в количестве 0.3% (ГЖХ).
1-Бром-2,3,5,6-тетрафтор-4-хлорбензол (9) (98.3% по данным ГЖХ). Т. пл. 55-57ºC. Спектр ЯМР 19F, δ, м.д.: 22.6 м (F3,5), 30.3 м (F2,6). УФ-спектр (гексан), λмакс, нм (lgε,): 222 (4.00). ИК-спектр (KBr), ν, см-1: 1742, 1634, 1493, 1462, 995, 964, 808, 594. Найдено, %: С 27.20; Br 30.50; Cl 13.30; F 29.17. M+ 261.8801 C6BrClF4. Вычислено, %: C 27.36; Br 30.33; Cl 13.46; F 28.85. M+ 261.8803.
5,6-Дибромоктафториндан (15). (99.7% по данным ГЖХ). Т. пл. 37.5-38.5°C (пентан). Спектр ЯМР 19F, δ, м.д.: 31.7 квинт (2-CF2, J2-CF2–1,3-CF2 ~ 4 Гц), 53.7 м (1(3)-CF2), 57.9 м (F4,7). УФ-спектр (гексан), λмакс, нм (lgε,): 221 (3.79), 238 (3.64), 243 (3.57, плечо), 280 (3.03), 288 (3.14). ИК-спектр (KBr), ν, см-1: 1724, 1624, 1607, 1460, 1439, 1398, 1331, 1290, 1246, 1221, 1205, 1159, 1096, 1051, 949, 874, 800, 689, 671, 575, 536. Найдено, %: С 26.09; F 36.37; Br 38.08. M+ 417.8230. C9Br2F8. Вычислено, %:C, 25.74; F, 36.20; Br 38.06. M+ 417.8234.
1-Бром-2,4,5-трифтор-3,6-дихлорбензол (18) (98.3% по данным ГЖХ). Перегонкой в вакууме (~12 мм рт. ст.) 4.74 г смеси получили 2.64 г фракции с т.кип. 94-95°C и чистотой 98.3% и 1.27 г фракции с т.кип. ~95°C и чистотой 95.1% по данным ГЖХ. Спектр ЯМР 19F, δ, м.д.: 27.6 д.д (F5, JF5-F4 21, JF5-F2 9.5 Гц), 28.9 д (F4, JF4-F5 21 Гц), 57.0 д (F2, JF2-F5 9.5 Гц). УФ-спектр (гексан), УФ -спектр (гексан) λмакс, нм (lgε,): 225 (4.06), 280 (2.85). ИК-спектр (плёнка), ν, см-1: 1597, 1468, 1441, 1354, 1308, 1076, 964, 874, 748, 700, 638. Найдено, %: С 25.91; Br 28.50; Cl 25.17; F 20.26. M+ 277.8508 C6Cl2BrF3. Вычислено, %: C 25.75; Br 28.55; Cl 25.34; F 20.36. M+ 277.8507.
1-Бром-2,5-дифтор-3,4,6-трихлорбензол (19) (96.9% по данным ГЖХ). Перегонкой в вакууме (~12 мм рт. ст.) 2.69 г смеси получили 1.20 г фракции с т.кип. ~127°C и чистотой 96.9% и 0.94 г фракции с т.кип. 127-128°C и чистотой 96.5% по данным ГЖХ. Т. пл. 94-96ºC. Спектр ЯМР 19F, δ, м.д.: 52.5 д (F5, JF5-F2 11 Гц), 60.4 д (F2, JF2-F5 11 Гц). УФ-спектр (гексан)* λмакс, нм (lgε,): 229 (4.12), 232 (4.13), 282 (3.26, плечо), 290 (3.35). ИК-спектр (KBr), ν, см-1 1435, 1387, 1287, 1252, 901, 881, 860, 698, 677, 631. Найдено, %: С 24.50; Br 27.00; Cl 35.90; F 13.03. M+ 293.8210 C6Cl3BrF2. Вычислено, %: C 24.32; Br 26.97; Cl 35.89; F 12.82. M+ 293.8212.
5-Бромоктафтор-6-хлориндан (21) (98.3% по данным ГЖХ). Спектр ЯМР 19F, δ, м.д.: 31.8 квинт (2-CF2, J2-CF2–(1)3-CF2 ~4.5 Гц), 48.5 д.т (F7, JF7-F4 19.5 Гц, J F7–1-CF2 7.5 Гц), 53.8 и 54.6 уширенные мультиплеты (1(3)-CF2), 56.7 д.т (F4, JF4-F7 19.5 Гц, JF4–3-CF2 7.5 Гц). УФ спектр (гексан), λмакс, нм (lgε,): 234 (3.93), 279 (3.34), 287 (3.42). ИК спектр (плёнка), ν, см-1:, 1612, 1464, 1441, 1408, 1315, 1302, 1248, 1207, 1157, 1099, 1059, 966, 949, 880, 818, 702, 673, 592, 579, 546. Найдено, %: С 28.36; Br 21.50; Cl 9.90; F 40.44. M+ 373.8732. C9BrClF8. Вычислено, %: C 28.79; Br 21.28; Cl 9.44; F 40.48. М+ 373.8739.
Реакции сопиролиза полифторарентиолов в проточной системе.
Реакцию сопиролиза тиола 8 с Br2 проводили в кварцевой трубке (реактор размерами 400 × 20 мм), нагреваемой в электрической трубчатой печи. Перед началом подачи систему предварительно продували аргоном. Подачи брома и тиола 8 в реактор осуществлялись одновременно из отдельных капельных воронок в токе аргона (~3 л/ч). Тиол 8 предварительно расплавляли. Продукты бромирования собирали в приёмник, охлаждаемый ледяной водой. Далее реакционную массу доводили до комнатной температуры, затем обрабатывали раствором сульфита натрия для удаления брома, после этого перегоняли с паром. Полученный твердый продукт отделяли от воды, сушили над CaCl2 и анализировали методами ЯМР 19F и ГЖХ. Результаты приведены в таблице 2.
Таблица 2
№ опыта |
Соединение 8, г (ммоль) |
Бром, г (ммоль) |
Мольное соотношение тиола к Br2 |
Температура, °С |
Выход смеси, г |
Содержание (выход) продукта 9 по ГЖХ, % |
Содержание (выход) продукта 7 по ГЖХ, % |
1 |
43.50 (200.85) |
88.10 (551.54) |
2.75 |
350 |
22.83А |
92.7 (40) |
3.8 (1) |
2 |
4.07 (18.79) |
8.77 (54.81) |
2.92 |
450 |
4.24 |
71.6 (61) |
26.2 (19) |
3 |
2.75 (12.70) |
9.36 (58.50) |
4.61 |
550 |
2.95 |
21.0 (18) |
77.7 (58) |
4 |
3.04 (14.04) |
13.80 (86.60) |
6.17 |
650 |
2.94 |
22.9 (18) |
64.1 (44) |
АКубовый остаток экстрагировали CHCl3 3×20 мл, после упаривания на ротационном испарителе получили 31.14 г с содержанием тиола 8 56% по данным ГЖХ.
5,6-Дибромоктафториндан (15). Реакцию проводили в проточном реакторе аналогично сопиролизу тиола 8 с бромом. Из 9.70 г (26.00 ммоль) тиола 13 и 18.38 г (114.88 ммоль) Br2 при ~500°C получено 9.90 г продукта. Содержание соединения 15 по ГЖХ – 98%, выход 85%.
Работа выполнена при финансовой поддержке РФФИ (проект № 15-03-08869а).
Список литературы
- Brooke G.M. The preparation and properties of polyfluoroaromatic and heteroaromatic compounds. J. Fluorine Chemistry. 1997. V. 86. № 1. P. 1–76.
- Платонов В.Е., Максимов А.М., Дворникова К.В., Никульшин П.В. Фторорганические серосодержащие соединения. V. Сопиролиз полифторарентиолов, -гетарентиолов и их производных с хлором и бромом. ЖОрХ. 2005. Т. 41. Вып. 11. С. 1681–1687. Platonov V.E., Maksimov A.M., Nikul’shin P.V., Dvornikova K.V. Organofluorine sulfur-containing compounds: V. Joint pyrolysis with chlorine or bromine of polyfluoroarenethioles, polyfluorohetarenethioles, and their derivatives Russ J. Org. Chem. 2005. V. 41. № 11. P. 1647-1653.
- Platonov V.E., Nikulshin P.V., Maximov A.M. Substitution of thiol groups in polyfluoroarenethiols for chlorine and bromine atoms. Production of chloro- and bromopolyfluoroarenes. Fluorine Notes. 2010. Vol. 1. /contents/history/2010/1_2010/letters/index.html.
- Никульшин П.В., Максимов А.М., Платонов В.Е., Получение хлорполифтораренов из полифторарентиолов и PCl5. ЖОрХ. 2016. Т. 52. Вып. 2. С. 217–221. Nikul’shin P.V., Maksimov A.M., Platonov V.E. Synthesis of Chloropolyfluoroarenes from Polyfluoroarenethiols and PCl5. Russ J. Org. Chem. 2016. V. 52. № 2. P. 200-205.
- Antonucci J., Wall L. High-Temperature Reactions of Hexafluorobenzene. J. Res. Nat. Bur. Stand. 1966. V. 70a. № 3. P. 473-480.
- Neil R.J., Peach M.E., Spinney H.G., Pentafluorobenzenesulfenyl Halides and Pseudohalides. Inorg. Nucl. Chem. Lett. 1970. V. 6. № 5. P. 509–510.
- Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. Ред. В.Н.Кондратьев. М. Наука. 1974.
- Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М. Мир. 1979. С. 345. Cotton F.A., Wilkinson G. Advanced Inorganic Chemistry. N.-Y.: Intersci. Publ., a Division of J.Wiley&Sons Inc., 1966.
- Реми Г. Курс неорганической химии, Том 1. М. Издательство иностранной литературы. 1963. С. 693. Remy H. Lenrbuch der Anorganischen Chemie. Band I. Akademische Verlagsgesellschaft Geest & Portig K.-G. Leipzig. 1960.
- Hartley S.B., Holmes W.S., Jacques J.K., Mole M.F., McCoubrey J.C. Thermochemical properties of phosphorus compounds. Quarterly reviews. 1963. V. 17. № 2. P. 204–223.
- Некрасов Б.В. Курс общей химии, М. Государственное научно-техническое издательство химической литературы. 1960. С. 396.
- Общая органическая химия. Ред. Кочетков Н.К., Нифантьев Э.Е., Членов М.А. М.: Химия. 1983. Т. 4. С. 635–636. Smith, L.J.H., Comprehensive Organic Chemistry. The Synthesis and Reactions of Organic Compounds, Barton, D. and Ollis, W.D., Eds., Oxford: Pergamon Press, 1979. V. 2. P. 1158.
- Maksimov A.M., Platonov V.E. Reactions of some polyfluoroaromatic compounds with potassium hydrosulfide. Fluorine Notes. 1999. Vol. 4. /contents/history/1999/4_1999/letters/index.html.
- Muller N., Lauterbur P.C., Goldenson J. Nuclear Magnetic Resonance Spectra of Phosphorus Compounds. J. Am. Chem. Soc. 1956. V. 78. № 15. P. 3557–3561.
- Пушкина Л.Н., Степанов А.П., Жуков В.С., Наумов А.Д. Спектры ЯМР 19F замещённых пентафторбензолов. ЖОрХ. 1972. Т. 8. Вып. 3. С. 586-597.
Статья рекомендована к публикации членом редколлегии проф. В.Е. Платоновым
Fluorine Notes, 2016, 106, 1-2
