Received: февраль 2013
Fluorine Notes, 2013, 87, 3-4
Синтез и исследование антибактериальной активности некоторых производных фторзамещенных акридонов
Т.Н.Кудрявцева,a К.В.Богатырев,a П.И.Сысоев,a Яр Зар Хтун,a Л.Г. Климова b
a Курский государственный университет, 305000, г. Курск, ул. Радищева 33
aКурский государственный медицинский университет, 305041, г. Курск, ул. Карла Маркса, 3
e-mail: labOS.kgu@mail.ru
Аннотация. N - Алкилированием 2- и 4 фторакридона синтезированы 2- и 4-фторзамещенные акридонуксусные кислоты. Получены новые производные 2-фторакридонуксусной кислоты, исследована их антибактериальная активность.
Ключевые слова: фторзамещенные акридоны, кинетические характеристики реакций, фторзамещенные акридонуксусные кислоты, производные, антибактериальная активность
В настоящее время различные биологически-активные производные акридона успешно применяются в медицине в качестве противоопухолевых [1,2], противогрибковых [3,4], антимикробных [5], противовирусных [6,7] и антипаразитарных [8] агентов. Одним из перспективных направлений является синтез производных фторзамещенных акридонов, среди которых уже найдены продукты, обладающие эффективным противоопухолевым [9-13], антималярийным [14] и инсектицидным [15] действием.
Циклизацией 2'- и 4’-фтордифениламин-2-карбоновых кислот в полифосфорной кислоте (ПФК) с содержанием Р2О5 80±0,5 % были синтезированы соответственно 4- и -2- фторакридоны:
Схема 1
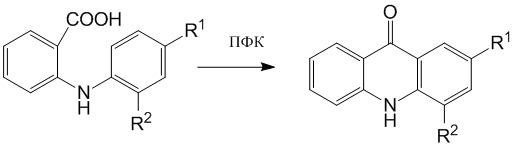
R1=H, R2=F; R1=F, R2=H
Ранее было показано, что использование ПФК в качестве циклизующего агента более целесообразно по сравнению с концентрированной серной кислотой, поскольку исключает протекание побочной реакции сульфирования образующегося акридона и обеспечивает практически количественный выход целевого соединения [16].
В продолжение работ по изучению кинетики циклизации дифениламин-2-карбоновых кислот (ДФКК) [16,17] методом тонкослойной хроматографии с денситометрией были определены кинетические характеристики циклизации фтордифениламин-2-карбоновых кислот (ФДФКК) в ПФК с соотношением кислота : ПФК = 1:4 (по массе).
Кинетические исследования проводили методом тонкослойной хроматографии с денситометрией. Полученные хроматограммы обрабатывали на видеоденситометре «Денскан» при длине волны 254 нм по программе «Сорбфил 1.8» [18].
По результатам обработки хроматограмм рассчитывали степень расходования исходной ФДФКК (α ФДФКК =C ФДФКК /C ФДФКК,0), по полученным кинетическим кривым строили их анаморфозы и рассчитывали константы скорости реакций (рисунки 1, 2).

Рис. 1. Кинетические кривые расходования 4’-фтор ДФКК (А) при циклизации в ПФК и их анаморфозы (Б) при различных температурах: 1-80°С, 2- 90°С, 3 - 100°С, 4-110oC

Рис. 2. Кинетические кривые расходования 2’-фтор ДФКК (А) при циклизации в ПФК и их анаморфозы (Б) при различных температурах: 1-80°С, 2- 90°С, 3 - 100°С, 4-110°C
Полученные данные позволили рассчитать энергию активации при проведении процесса и сравнить полученные результаты с соответствующими характеристиками, полученными ранее для акридонов с иными заместителями.
Таблица 1.Значения констант скоростей и энергий активации процессов циклизации замещенных дифениламин-2-карбоновых кислот в ПФК
|
Исходная ДФКК |
Константа скорости, k × 10-4, с-1, при Т °С |
Энергия активации, кДж/моль |
||||
|
70°C |
80°C |
90°С |
100°С |
110°С |
||
|
Незамещ |
1,52±0,07 |
4,13±0,17 |
10,5± 0,50 |
25,90±1,11 |
- |
100,0±4,4 [16] |
|
2’-CH3 |
0,70± ,03 |
1,93± 0,09 |
4,52± 0,22 |
11,20± 0,55 |
- |
93,0±4,1 [16] |
|
4’-CH3 |
0,74± ,04 |
3,19± 0,13 |
5,51± 0,23 |
15,40± 0,63 |
- |
103,0±5,1 [16] |
|
2'-Br |
6,60± ,26 |
18,80± 0,88 |
40,60±2,01 |
119,80± 4,80 |
– |
95,0±4,2 [16] |
|
2’-F |
- |
2,99± 0,14 |
5,85± 0,25 |
10,64± 0,51 |
24,53± 1,10 |
77,5±3,8 |
|
4’-F |
- |
6,89±0,28 |
12,24±0,49 |
16,77± 0,83 |
28,92± 1,36 |
54,0± 2,6 |
Как следует из данных табл. 1, значения констант скорости реакций циклизации фторзамещенных дифениламин-2-карбоновых кислот весьма близки к соответствующим значениям констант скорости для метилзамещенных ДФКК. Циклизация 2’-бром ДФКК характеризуется более высокими значениями констант скорости реакции по сравнению с 2’-фтор ДФКК. В целом же введение атома фтора в молекулу дифениламин-2-карбоновой кислоты приводит к весьма значительному снижению энергии активации процесса ее циклизации в соответствующий акридон.
Полученные фторакридоны алкилировали бутиловым эфиром хлоруксусной кислоты в среде ДМФА с использованием гидрида натрия.
Схема 2
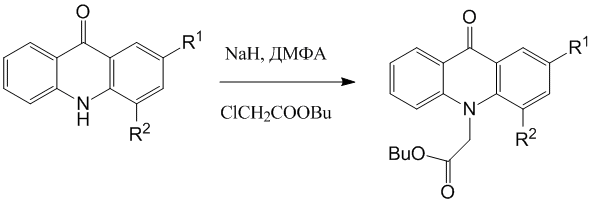
R1=H, R2=F; R1=F, R2=H
Ранее в ходе серии экспериментов было установлено, что алкилирование акридонов с заместителем в положении 4 (CH3, Br, NO2, COOH) бутиловым эфиром хлоруксусной кислоты в среде ДМФА протекает чрезвычайно трудно и с очень низким выходом, вероятно, в связи с пространственными затруднениями. В случае 4-фторакридона указанное превращение осуществлено нами с выходом 54 %. По-видимому, это обусловлено относительно малой величиной эффективного радиуса атома фтора.
Синтез бутилового эфира 2-фторакридонуксусной кислоты прошел с практически количественным выходом, поэтому, вследствие более высокой доступности этого соединения по сравнению с эфиром 4-фторакридонуксусной кислоты, именно оно было использовано для получения производных, потенциально обладающих биологической активностью.
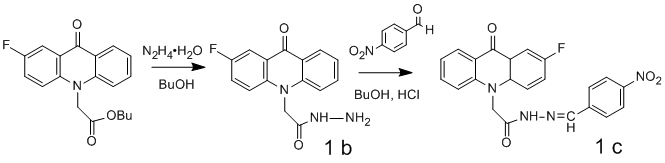
Переэтерификацией бутилового эфира 2-фторакридонуксусной кислоты (2-F-АУК) в среде 4-метил-5-(2-гидроксиэтил)тиазола с использованием метилата натрия в качестве катализатора синтезировали 2-(4-метил-1,3-тиазол-5-ил)этил-(2-фтор-9-акридон-10-ил)ацетат (1а):
Схема 3

Способность тиазолильного сложного эфира 1а к образованию водорастворимого гидрохлорида использовали для очистки продукта от исходного бутилового эфира.
Гидразид 2-F-АУК (1b) был получен гидразинолизом бутилового эфира 2-F-АУК. Реакцией конденсации гидразида 2-F-АУК (1b) и 4-нитробензальдегида получили арилиденгидразид 2-F-АУК (1c). Указанная реакция протекает достаточно быстро при комнатной температуре при кислотном катализе в среде бутанола.
Схема 4
Продукты 1a, 1b и 1c (растворы различной концентрации в ДМСО) были исследованы на антимикробную активность по отношению к тест-штаммам микроорганизмов. Результаты микробиологических исследований приведены в таблице 2.
Соединение 1a проявило достаточно высокую активность относительно Candida albicans, сравнимую с показателями для стандартного препарата акридинового ряда риванола. Соединения 1b и 1c также проявили высокую активность по отношению к грамположительным и грамотрицательным микроорганизмам. При этом арилиденгидразид 1с превзошел риванол по отношению ко всем исследуемым тест-штаммам.
Сравнение антибактериальной активности полученных производных 2-F-АУК с аналогичными производными незамещенной акридонуксусной кислоты показало, что фторсодержащие вещества 1a, 1b и 1c более эффективно подавляли рост микроорганизмов, по сравнению с их незамещенными аналогами.
Таблица 2. Противомикробная активность соединений 1a, 1b, c.
|
Вещество |
С, % |
Е. coli (АТСС 25922) |
Ps. aeruginosa (АТСС 27853) |
Pr.vulgaris (АТСС 4636) |
S. aureus (АТСС 25923) |
B.subtilis (АТСС 6633) |
Candida albicans (NCTC2625) |
|
Зона задержки роста, мм |
|||||||
|
1a |
0,5 |
8,00±0,62 |
10,00±0,37 |
12,25±0,87 |
14,25±0,87 |
9,75±0,82 |
14,50±0,62 |
|
1,0 |
8,80±0,71 |
10,05±0,94 |
11,50±0,32 |
14,00±0,75 |
10,0±0,37 |
13,50±0,94 |
|
|
2,0 |
9,00±0,75 |
13,50±0,66 |
15,00±1,09 |
14,50±0,97 |
11,50±0,32 |
15,00±1,09 |
|
|
1b |
0,5 |
14,25±0,57 |
9,50±0,50 |
10,00±0,37 |
12,00±0,23 |
9,05±0,37 |
14,25±0,30 |
|
1,0 |
13,50±0,66 |
10,00±0,37 |
12,75±0,38 |
15,00±1,09 |
11,50±0,32 |
17,00±0,43 |
|
|
2,0 |
16,75±0,38 |
14,75±0,38 |
14,25±0,57 |
18,75±0,82 |
14,25±0,57 |
19,25±0,78 |
|
|
1c |
0,5 |
15,50±0,66 |
14,25±0,57 |
14,50±0,50 |
17,25±0,75 |
11,50±0,32 |
18,75±0,82 |
|
Риванол |
1,0 |
12,75±0,47 |
12,00±1,14 |
12,50±0,83 |
17,00±1,02 |
14,05±0,94 |
13,50±0,56 |
|
2,0 |
14,50±0,57 |
15,00±0,93 |
15,00±0,66 |
20,00±0,97 |
15,00±1,14 |
15,00±0,96 |
|
Экспериментальная часть
Чистоту исходных соединений и продуктов реакций контролировали методом ТСХ (пластины «Sorbfil» ПТСХ-П-В-УФ, элюент - толуол: ацетон: этанол в объемных соотношениях 10:3:2). Состав и структуру веществ подтверждали методами ИК-спектроскопии (ИК-Фурье спектрометр ФСМ 1201, фирмы Мониторинг, таблетки в KBr), хроматомасс-спектрометрии (система ACQUITY UPLC H-Class с УФ/масс-детекторами ACQUITY SQD компании Waters), УФ спектроскопии (УФ-спектрометр UV-1800 фирмы Shimadzu).
ЦиклизациюФФАК в соответствующие акридоны осуществляли по методике [18], N-алкилирование - по методике [19] с некоторыми изменениями (реакцию проводили при 110 °С в течение 4 часов с одномоментной загрузкой бутилхлорацетата).
2-Фторакридон. Кристаллическое вещество желтого цвета. Выход: 96 %. Тпл >340 °С. Rf =0,62. Масс-спектр, m/z (Iотн (%)): 214 [М+H]+ (100). ИК-спектр (KBr) ν, см -1: 3458-2933 (N-Н, С-Н), 1634 (С=О), 1603-1482 (С-Сар). УФ-спектр (MeОН), λmax/нм (lg ε): 406 (0,506); 386 (0,502); 247 (2,19); 212 (0,998).
4-Фторакридон. Кристаллическое вещество желтого цвета. Выход: 96 %. Тпл =318 ±2 °С. Rf =0,76. Масс-спектр, m/z (Iотн (%)): 214 [М+H]+ (100). ИК-спектр (KBr) ν, см -1: 3466-2952 (N-Н, С-Н), 1630 (С=О), 1603-1481 (С-С ар). УФ-спектр (MeОН), λmax/нм (lg ε): 395 (0,399); 377 (0,403); 251 (2,497); 215 (1,055).
Бутиловый эфир 2-фторакридонуксусной кислоты. Кристаллическое вещество бледно-желтого цвета. Выход: 94 %. Тпл = 148 ±2 °С. Rf =0,84. Масс-спектр, m/z (Iотн (%)): 328 [М+H]+ (100), 272 [C15H10FNO3+H]+ (36). ИК-спектр (KBr) ν, см -1: 2961 - 2876 (С—Н); 1738 (С=О); 1620 (С=Оакридона), 1601, 1504, 1494, 1465 (С-С ар). УФ-спектр (MeОН), λmax/нм (lg ε): 404 (0,396), 386 (0,340), 258 (1,455), 248 (1,652).
Бутиловый эфир 4-фторфторакридонуксусной кислоты. Кристаллическое вещество желтого цвета. Выход: 54 %. Тпл = 142 ±2 °С. Rf =0,82. Масс-спектр, m/z (Iотн (%)): 328 [М+H]+ (100), 272 [C15H10FNO3+H]+ (71), 226 [C14H10FNO – H]+ (12), 213 [C13H8FNO]+ (4). ИК-спектр (KBr) ν, см -1: 2958 - 2871 (С—Н); 1752 (С=О); 1636 (С=Оакридона), 1602, 1501, 1460 (С-С ар). УФ-спектр (MeОН), λmax/нм (lg ε): 395 (0,807), 252 (2,605), 216 (1,674).
2-(4-Метил-1,3-тиазол-5-ил)этил-(2-фтор-9-акридон-10-ил)ацетат (1a). Смесь 1 г (0,0031 моль) бутилового эфира 2-фтор АУК, 6 г (0,042 моль) 4-метил-5-(2-гидроксиэтил)тиазола и 20 мкл 20%-го раствора NaOCH3 в CH3OH выдерживают при 120 °С в течение 4 часов. Реакционную массу выливают в воду, полученный осадок промывают горячей водой, затем растворяют в 50 мл 2 %-го раствора НСl. Нерастворимый осадок (исходный бутиловый эфир) отфильтровывают, солянокислый фильтрат нейтрализуют раствором соды. Выпавший осадок промывают водой, сушат и перекристаллизовывают из бутанола.
Кристаллическое вещество бледно-желтого цвета. Выход: 77 %. Тпл = 144 ±2 °С. Rf =0,60. Масс-спектр, m/z (Iотн (%)): 397 [М+H]+ (100), 272 [C15H10FNO3+H]+ (10). ИК-спектр (KBr) ν, см -1: 3067 - 2924 (С—Н); 1746 (С=О); 1638 (С=Оакридона), 1601, 1491, 1467 (С-С ар), 1414 (тиазольн. кольцо). УФ-спектр (MeОН), λmax/нм (lg ε): 405 (0,314), 386 (0,279), 247 (1,478).
Гидразид
2-фторакридонуксусной кислоты (1b).К смеси 0,5 г (0,0015 моль) бутилового эфира 2-фтор
АУК и 5 мл бутилового спирта, добавляют 0,25 мл гидразин моногидрата, реакционную смесь кипятят
при перемешивании в течение 2 часов. Выпавший осадок фильтруют и перекристаллизовывают из
ДМФА.
Кристаллическое вещество желтого цвета. Выход: 84 %. Т.пл = 285±2 °С. Rf = 0,49. Масс-спектр, m/z (Iотн (%)): 286 [М+H]+ (100), 269 [C15H10 FN2O2 + H]+ (15), 226 [C14H10FNO – H]+ (15), 213 [C13H8FNO]+ (100). ИК-спектр (KBr), ν/см–1: 3437, 3317 (NH—NH2); 3001, 2918 (С—Н); 1672 (C=О); 1615 (С=Оакридона); 1599, 1580, 1497, 1466 (С-Сар). УФ-спектр (MeОН), λmax/нм (lg ε): 407 (0,115), 388 (0,096), 247 (0,576), 291 (0,833).
N-[2-(4-Нитрофенил)-1-азавинил]-2-(2-фтор-9-оксо(10-гидро-акридин-10-ил)
ацетамид (1c). Смесь 0,5 г (0.0017 моль) гидразида 2-фтор акридонуксусной кислоты
(1b) и 0,3 г (0.0019 моль) 4-нитробензальдегида в 10 мл бутилового спирта, подкисленную несколькими
каплями концентрированной HCl, выдерживают при комнатной температуре и перемешивании в течение
1 часа. Выпавший осадок фильтруют, перекристаллизовывают из ДМФА.
Кристаллическое вещество желтого цвета. Выход: 85 %. Т.пл = 296±2 °С. Rf =0,63. Масс-спектр, m/z (Iотн (%)): 419 [М+2H]+ (100). ИК-спектр (KBr), ν/см–1: 3432 (NH); 2924, 2849 (С—Н); 1691 (C=O); 1620 (С=Оакридона); 1599, 1524, 1466 (С-Сар). УФ-спектр (MeОН), λmax/нм (lg ε): 405 (0,142), 387 (0,147), 321 (0,448), 248 (0,633).
Определение антимикробной активности
Определение антимикробной активности проводили по методике [20]. Стеклянные чашки Петри, установленные на столиках со строго горизонтальной поверхностью, заливали расплавленной агаровой средой, предварительно засеянной тест-штаммами микроорганизмов.
Взвесь тест-микробов для посева на чашки Петри готовили по стандарту мутности на 10 ЕД. В качестве посевного материала использовали суточные культуры. Взвесь каждого вида микроорганизма засевали на чашку Петри. Микробная нагрузка составляла 1000000 микробных клеток в 1 мл.
При определении антимикробной активности исследуемых веществ готовили их растворы концентрацией 0, 5%, 1,0 % и 2,0 %. помещали в центр цилиндра (0,1 мл). Затем чашки инкубировали при температуре (37 ± 1) °С в течение 18-20 ч. В качестве сравнительного образца использовали стандартный раствор риванола в тех же концентрациях.
Диаметр зон угнетения роста тест-микробов измеряли при помощи микролинейки с точностью до 1 мм.
Литература
- Tabarrini O., Cecchetti V., Fravolini A., Nocentini G., Barzi A., Sabatini S., Miao H., Sissi C. Design and synthesis of modified quinolones as antitumoral acridones // J. Med. Chem. 1999. V. 42.N 12. P. 2136-2144.
- Sathish N.K., GopKumar P., Rajendra Prasad V.V.S., Shanta Kumar S.M., Mayur Y.C. Synthesis, chemical characterization of novel 1,3-dimethyl acridones as cytotoxic agents, and their DNA-binding studies // Med. Chem. Res. 2010. V. 19.N 7. P. 674-689.
- Ahua K.M., Ioset J.R., Ransijn A., Mauel J., Mavi S., Hostettmann K. Antileishmanial and antifungal acridone derivatives from the roots of Thamnosma rhodesica // Phytochemistry. 2004. V. 65.N 7. P. 963–968.
- Meepagala K.M., Schrader K.K., Wedge D.E., Duke S.O. Algicidal and antifungal compounds from the roots of Ruta graveolens and synthesis of their analogs // Phytochemistry. 2005. V. 66.N 22. P. 2689–2695.
- Salimon J., Salih N., Yousif E., Hameed A., Kreem A. Synthesis and pharmacological evaluation of 9(10H)-acridone bearing 1,3,4-oxadiazole derivatives as antimicrobial agents // Arab. J. Chem. 2010. V. 3.N 4. P. 205–210.
- Yamamoto N., Furukawa H., Ito Y., Yoshida S., Maeno K., Nishiyama Y. Anti-herpesvirus activity of citrusinine-I, a new acridone alkaloid, and related compounds // Antiviral Res. 1989. V. 12.N 1. P. 21–36.
- Fujiwara M., Okamoto M., Okamoto M., Watanabe M., Machida H., Shigeta S., Konno K., Yokota T., Baba M. Acridone derivatives are selective inhibitors of HIV-1 replication in chronically infected cells // Antiviral Res. 1999. V. 43.N 3. P. 189–199.
- Lacroix D., Prado S., Kamoga D., Kasenene J., Bodo B. Structure and in vitro antiparasitic activity of constituents of Citropsis articulata root bark // J. Nat. Prod. 2011. V. 74. N 10. P. 2286–2289.
- Rajendra Prasad V.V.S., Peters G.J., Lemos C., Kathmann I., Mayur Y.C. Cytotoxicity studies of some novel fluoro acridone derivatives against sensitive and resistant cancer cell lines and their mechanistic studies // Eur. J. Pharm. Sci. 2011. V. 43.N 4. P. 217–224.
- Fadeyi O.O., Adamson S.T., Myles E.L., Okoro C.O. Novel fluorinated acridone derivatives. Part 1: Synthesis and evaluation as potential anticancer agents // Bioorg. Med. Chem. Lett. 2008. V. 18.N 14. P. 4172–4176.
- Rajendra Prasad V.V.S., Honeywell R., Rao J.V., Sathish N.K., Shanta Kumar S.M., Mayur Y.C. Characteristic fragmentation behavior of some novel anti-calmodulin acridone derivatives studied by electrospray ionization tandem mass spectrometry // Int. J. Mass Spectrom. 2007. V. 263.N 2–3. P. 148–151
- Mayur Y.C., Zaheeruddin, Peters G.J., Lemos C., Kathmann I., Rajendra Prasad V.V.S. Synthesis of 2-Fluoro N10-substituted acridones and their cytotoxicity studies in sensitive and resistant cancer cell lines and their DNA intercalation studies // Arch. Pharm. 2009. V. 342.N 11. P. 640 – 650.
- Dorner B., Kuntner C., Bankstahl J.P., Wanek T., Bankstahl M., Stanek J., Müllauer J., Bauer F., Mairinger S., Loscher W., Miller D.W., Chiba P., Muller M., Erker T., Langer O. Radiosynthesis and in vivo evaluation of 1-[18F]fluoroelacridar as a positron emission tomography tracer for P-glycoprotein and breast cancer resistance protein // Bioorg. Med. Chem. 2011. V.19.N 7. P. 2190-2198.
- >Winter R.W., Kelly J.X., Smilkstein M.J., Dodean R., Bagby G.C., Rathbun R.K., Levin J.I., Hinrichs D., Riscoe M.K. Evaluation and lead optimization of anti-malarial acridones // Exp. Parasitol. 2006. V. 114.N 1. P. 47–56.
- US Pat. 4474774 (1984)
- Пелевин Н.А., Лоторев Д.С., Лапин А.В., Брылев М.И., Гуров М.Ю. / Материалы междунар. науч. конф. молодых ученых, аспирантов и студентов «Перспектива-2008». Нальчик: КБГУ. 2008. Т. III. С. 214-218.
- Маркович Ю.Д., Кудрявцева Т.Н., Брылев М.И., Маркович В.Ю., Королева И.А. Кинетические параметры реакции внутримолекулярной конденсации дифениламин-2-карбоновых кислот в условиях микроволнового излучения // ЖОХ. 2012. Т. 82.N 1. С. 152–155
- Маркович Ю.Д., Пелевин Н.А., Кудрявцева Т.Н., Лоторев Д.С. Изучение кинетики реакций циклизации дифениламин-2-карбоновых кислот с использованием тонкослойной хроматографии с денситометрией // Зав. лабор. Диагностика материалов. 2008. N 4. С. 7-10.
- Szulc Z., Mlochowski J., Palus J. Synthesis of carbocyclic derivatives of 9 (10H)-acridinone, 9H-carbazole and 10H-phenothiazine 5,5-dioxide as potential immunomodulating agents // Journal f. prakt. Chemie. 1988. V. 330.N 6. P. 1023-1029.
- Государственная фармакопея СССР / Мин-во здравоохранения СССР. Изд.11. Вып.2. Москва, изд. “Медицина”. 1990.
Статья рекомендована к публикации членом редколлегии А.Ф. Елеевым
Fluorine Notes, 2013, 87, 3-4
