Received: декабрь 2012
Fluorine Notes, 2013, 86, 9-10
Особенности взаимодействия перфтораллилфторсульфата с фенолятом натрия в моноглиме
Э.В.Игумноваа, Т.В.Стрелковаб, Н.Д.Каграмановб, А.А.Тютюновб, В.Ф.Черстковб, С.Р.Стерлинб
аЗАО НПО «ПиМ-Инвест», 119991, Москва, ул. Вавилова, д.28
бФедеральное государственное бюджетное учреждение науки Институт элементоорганических соединений им. А.Н.Несмеянова Российской академии наук, 119991, ГСП-1, Москва, В-334, ул. Вавилова, д. 28
e-mail: sterlins@yandex.ru
Аннотация. Установлено, что в среде моноглима фенолят натрия реагирует с перфтораллилфторсульфатом с образованием 1,3-дифенокситетрафторпропилена в качестве основного продукта реакции. Это, ранее не описанное, направление реакции сопровождается взаимодействием перфтораллилфторсульфата с растворителем, что подтверждается образованием продуктов перфтораллилирования моноглима – метил- и 2-метоксиэтилперфтораллиловых эфиров.
Ключевые слова: перфтораллилфторсульфат, 1,3-дифенокситетрафторпропилен
Исследования реакции О-нуклеофилов с перфтораллилирующими реагентами насчитывает более чем полувековую историю [1]. Появление такого доступного и эффективного перфтораллилирующего агента как перфтораллилфторсульфат (1) [2,3] придал этому направлению фторорганической химии дополнительный импульс: на основе фторсульфата 1 были синтезированы разнообразные перфтораллиловые эфиры [4], в том числе и соединения, перспективные с точки зрения их промышленного применения [5].
Ранее, анализируя продукты реакции перфтораллил- или перфторбензилфторсульфатов с высшими галогенидами щелочных металлов в диглиме методом хромато-массспектроскопии, мы обнаружили, что они содержат следовые количества перфтораллил- или перфторбензилметиловых эфиров. Предположение, что эти эфиры образуются при разложении соответствующих ионов оксония – продуктов электрофильного алкилирования диглима перфтораллил- или перфторбензилфторсульфатом – требовало экспериментального подтверждения. В качестве объекта исследования нами была выбрана реакция перфтораллилфторсульфата с фенолятом натрия, подробно описанная ранее в [4].
Нами найдено, что в условиях получения фенилперфтораллилового эфира (2) (прибавление перфтораллилфторсульфата к раствору эквимольного количества фенолята натрия в ТГФ; выход эфира 2 87% [4]), но при использовании моноглима в качестве растворителя, основным продуктом реакции является 1,3-дифенокситетрафторпропен (3). Насколько нам известно, такое направление реакции перфтораллилфторсульфата с О-нуклеофилами ранее в литературе описано не было. В то же время появление среди продуктов реакции метилперфтораллилового (4) и метоксиэтилперфтораллилового (5) эфиров (4:5 ~ 1:1, суммарно 16 мол.% от 1, взятого в реакцию), образование которых описывается схемой с участием оксониевого иона (6), подтверждает ранее выдвинутое предположение о возможности электрофильного алкилирования фторсульфатом 1 простых эфиров углеводородного ряда:
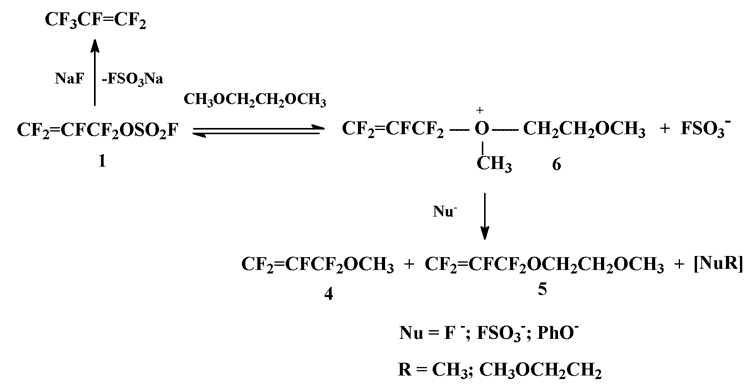
Схема 1
Реакция сопровождается выделением газа, по всей вероятности гексафторпропилена, образующегося при разложении фторсульфата 1 под действием NaF, генерируемым in situ.
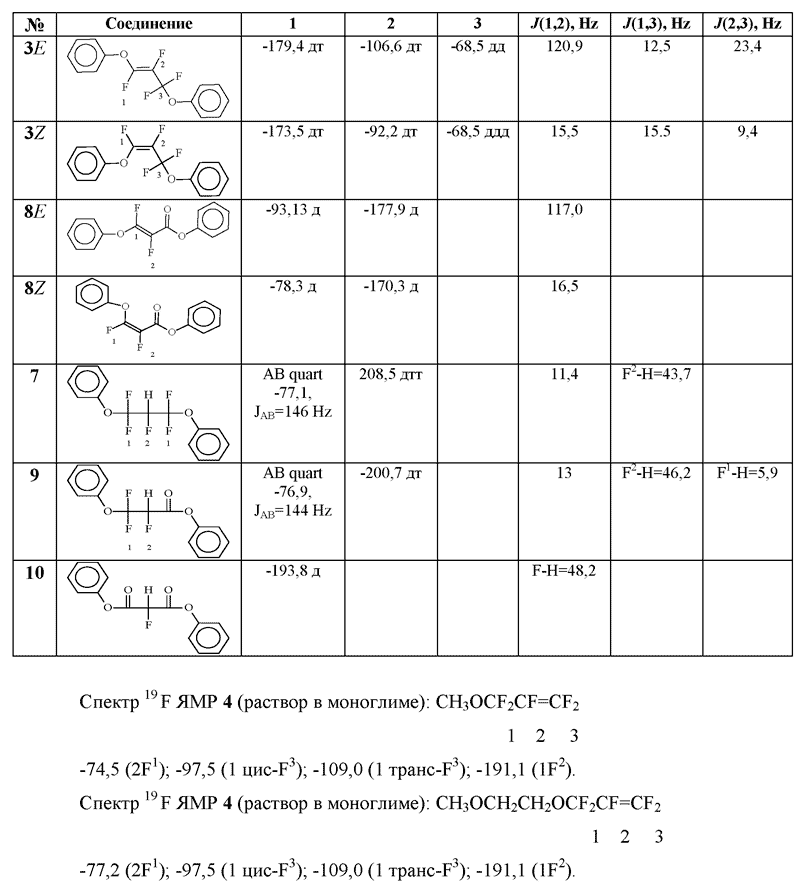
Дифеноксипропен 3 стабилен при ~25oC, однако при перегонке подвергается частичному гидролизу, что приводит к образованию смеси соединений 3,7-10 в мольном соотношении дифеноксипропилен 3:дифенокси-2-гидроперфторпропан 7:фенил-β-фенокси-α,β-дифторакрилат 8:фенил-2-гидро-3-фенокситрифторпропионат 9:дифенил-2-фтормалонат 10 = 20:2:1:1:3, которые разделить фракционированием не удалось.
Последовательность превращений, приводящих к соединениям 3,7-10, очевидна: гидролиз дифеноксипропилена 3 дает акрилат 8 и HF, который присоединяется к дифеноксипропилену 3 с образованием 1,3-дифенокси-2-гидроперфторпропана 7. В результате двухстадийного гидролиза последнего образуются фенилпропионат 9 и дифенилмалонат 10.
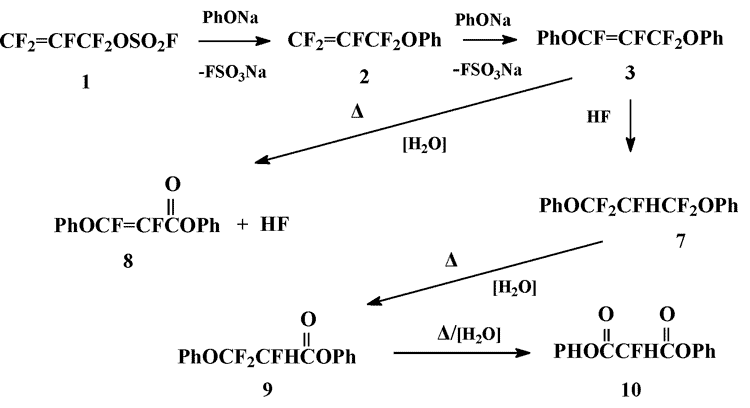
Схема 2
Попытки осуществить более глубокий гидролиз полученной смеси привели к неожиданным результатам. Так, ее кратковременная обработка 40%-ным KOH (70-90oC/8-10 мин) привела к смеси, содержащей только дифеноксипропилен 3 и дифенилмалонат 10 (мольное соотношение 3:10 = 9:1). В присутствии SiO2 при ~25oC начинает увеличиваться относительное содержание дифторакрилата 8. При повышении температуры реакционной массы до 140-145°С начинается бурная экзотермическая реакция, в результате которой основной компонент смеси – дифениоксипропен 3 - превращается в смесь дифторакрилата 8, фенилпропионата 9 и дифенилмалоната 10 (мольное соотношение 7:8:9:10 = 1:3,8:1:1,7) (по данным 19F ЯМР-спектроскопии). Дальнейшее повышение температуры до 170-175°С приводит к увеличению относительного содержания дифенилмалоната 10, однако при этом наблюдается осмоление реакционной массы.
Из полученных результатов следует, что перфтораллилфторсульфата 1 способен алкилировать простые эфиры углеводородного ряда в отсутствие электрофильного катализа с последующим образованием алкилперфтораллиловых эфиров. В связи с этим мы предлагаем альтернативный способ получения фенилперфтораллилового эфира 2 реакцией фенолята триэтиламмония с аллилфторсульфатом в гексане. Реакция осуществляется достаточно гладко и приводит к образованию эфира 2 с выходом 65%.

Схема 3
Экспериментальная часть
ЯМР 19F спектры записаны на спектрометре “Bruker AVANCE-300” при 282 MHz, внешний стандарт CDCl3 или D2O. Химические сдвиги спектров 19F приведены в м.д. относительно CFCl3. Масс-спектры записаны на масс-спектрометре Finnigan Polaris Q (Trace GC ultra).
Перфтораллилфторсульфат (1) получен по методу [2].
Реакция перфтораллилфторсульфата с фенолятом натрия
К смеси 34 г 60%-ной суспензии NaH в минеральном масле (0,81 моля) и 230 мл моноглима при 4-5°С постепенно, за 1 час, прибавили раствор 76 г (0,81 моля) фенола в 250 мл моноглима, к полученному раствору постепенно, за 1,3 часа, прибавили при перемешивании 186 г (0,81 моля) перфтораллилфторсульфата, поддерживая температуру реакционной массы 15-18°С (реакция слабоэкзотермична, наблюдается выделение газа). Смесь перемешивали 6 час., оставили на ночь, часть моноглима (220 мл) отогнали при 35 Torr. В полученном дистилляте содержатся 68,2 ммоля метилперфтораллиловогоэфира 4 и 60 ммолей метоксиэтилперфтораллилового эфира 5 (по данным 19F ЯМР-спектроскопии, внутренний стандарт BrCF2CF2Br).
Оставшийся растворитель отогнали в приемник (-78°С), постепенно понижая давление до 2-3 Torr (по данным 19F ЯМР-спектроскопии дистиллят содержит следовые количества фенилперфтораллилового эфира 2). Остаток растворили в CHCl3, выпавший осадок отфильтровали, фильтрат упарили в вакууме (2-3 Torr), из остатка перегонкой выделили 74 г фракции, выкипающей в интервале 110-165°C/1Torr, содержащей соединения 3,7-10 в мольном соотношении 3:7:8:9:10: = 20:2:1:1:3 (19F ЯМР).
Таблица 1. Спектры ЯМР 19F соединений 3,7-10.
Масс-спектр 4 (m/z, отнесение): 162 [M]+; 143 [M-F]+ (100%); 131 [C3F5]+; 128 [C3F4O]+; 112 [C3F4]+; 109 [C3F3O]+; 100 [C2F4]+; 93 [C3F3]+; 81 [C2F3]+; 78 [C2F2O]+; 69 [CF3]+; 47 [CFO]+; 31 [CF]+.
Масс-спектр 5 (m/z, отнесение): 206 [M]+; 175 [M-CH3O]+; 131 [C3F5]+ (100%); 112 [C3F4]+; 100 [C2F4]+; 93 [C3F3]+; 74 [C3H3FO]+; 69 [CF3]+; 59 [C2FO]+; 47 [CFO]+; 45 [C2H5O]+; 43 [C2F]+; 31 [CF]+; 29 [CHO]+; 27 [C2H3]+.
Масс-спектр 3 (m/z, отнесение): 298 [M]+; 279 [M-HF]+; 205 [M-PhO]+ (100%); 185 [C9H4F3O]+; 177 [C8H5F4]+; 139 [C8H5F2]+; 127 [C7H5F2]+; 109 [C3F3O]+; 77 [C6H5]+; 65 [C5H5]+.
Масс-спектр 7 (m/z, отнесение): 318 [M]+; 225 [M-PhO]+; 205 [M-PhO-HF]+; 177 [C8H5F4]+; 141 [C7H3F2O]+; 127 [C7H5F2]+; 94 [C6H6O]+ (100%); 77 [C6H5]+; 66 [CF2O]+; 51 [CHF2]+.
Масс-спектр 8 (m/z, отнесение): 277 [M+H]+; 259 [C15H9F2O2]+; 232 [M-CO2]+; 212 [C14H9FO]+; 183 [C9H5F2O2]+ (100%); 155 [C8H5F2O]+; 136 [C8H5FO]+; 127 [C7H5F2]+; 107 [C7H4F]+; 87 [C7H3]+; 77 [C6H5]+; 51 [CHF2]+.
Масс-спектр 9 (m/z, отнесение): 296 [M]+; 277 [M-F]+; 257 [M-HF2]+; 225 [C11H7F2O3]+; 212 [C14H9FO]+; 203 [M-PhO]+; 183 [C9H5F2O2]+; 155 [C8H5F2O]+; 141 [C7H3F2O]+; 127 [C7H5F2]+; 109 [C7H6F]+; 94 [C6H6O]+ (100%); 77 [C6H5]+; 66 [CF2O]+; 51 [CHF2]+.
Масс-спектр 10 (m/z, отнесение): 274 [M]+; 257 [C15H10FO3]+; 246 [M-CO2]+; 197 [C9H6FO4]+; 181 [M-PhO]+; 169 [C8H6FO3]+; 152 [C8H5FO2]+; 141 [C7H6FO2]+; 125 [C7H6FO]+; 105 [C7H5O]+; 94 [C6H6O]+ (100%); 89 [C7H5]+; 77 [C6H5]+; 66 [CF2O]+; 51 [CHF2]+.
Реакция перфтораллилфторсульфата с фенолятом триэтиламмония
К раствору 180 г (0,78 моля) фторсульфата 1 в 250 мл гексана при 10-15°С постепенно прибавили раствор фенолята триэтиламония [из 73,6 г (0,78 моля) фенола и 79 г (0,78 моля) триэтиламина] в 550 мл гексана, перемешивали 3 часа при ~25oC, затем двухфазную реакционную массу охладили в бане (-78°С) до полного застывания нижнего слоя, верхний слой декантировали, растворитель отогнали при пониженном давлении, остаток перегнали, собирая фракцию, выкипающую в интервале 53-71°С/29 Torr, и получили 116 г (66%) эфира 2, чистота 97%. Повторной перегонкой получили 101 г эфира 2, т.кип. 62-64°С/29 Torr (лит. данные: т.кип. 54°С/20 Torr [1].
Литература
- И.Л.Кнунянц, Б.Л.Дяткин, Изв. АН СССР, сер.хим., 1958, с.648
- C.G.Krespan, D.C.England, J.Am.Chem.Soc., 1981, 103, 5598
- C.G.Krespan, D.A.Dixon, J.Org.Chem., 1986, 51, 4460
- Wlassics, V.Tortelli, S.Carella, C.Monzani, G.Marchionni, Molecules, 2011, 16, 6512
- A.P.King, C.G.Krespan, US Pat. 4384128 (1983).
Материал рекомендован к публикации членом редколлегии С.Р. Стерлиным
Fluorine Notes, 2013, 86, 9-10
