Received: июнь 2011
DOI 547.594+547.539.141+547.652+547.586.2+547.235.421+548.737
Fluorine Notes, 2012, 84, 1-2
ПОЛИФТОРИРОВАННЫЕ ЦИКЛОГЕКСАДИЕНОНЫ – УДОБНЫЕ ПОЛУПРОДУКТЫ ДЛЯ СЕЛЕКТИВНОГО СИНТЕЗА СЛОЖНЫХ ФТОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Л.С.Кобрина, В.Н.Ковтонюк
Учреждение Российской академии наук Новосибирский институт органической химии им. Н.Н.Ворожцова Сибирского
отделения РАН, 630090, Новосибирск, пр. Лаврентьева, 9.
e-mail: kovtonuk@nioch.nsc.ru
Аннотация. Обобщены данные исследований реакционной способности полифторированных циклогексадиенонов: нуклеофильные реакции, циклоприсоединение и фотохимические трансформации. Обсуждено использование полифторированных циклогексадиенонов в качестве синтонов для синтеза широкого круга ранее недоступных фторированных органических соединений: производных полифениловых эфиров, арилуксусных кислот, производных нафталина и антрахинона, содержащих карбоксильную группу, циклогексенкарбоновых кислот, некоторых фторированных гетероциклических соединений.
Ключевые слова: фторорганические соединения, циклогексадиеноны, нуклеофильные реакции, циклоприсоединение, полифениловые эфиры, арилуксусные кислоты.
Проблема функционализации фторированных соединений имеет фундаментальное значение как из-за ограниченных возможностей синтеза таких производных прямым введением атомов фтора в органические соединения, содержащие функциональные группы, так и из-за сложности введения функциональных групп во фторированные соединения, что требует многостадийных синтезов [1]. Нами был найден новый и перспективный подход к синтезу полифункциональных фторорганических соединений посредством преобразования относительно доступных полифторароматических соединений в высокореакционные полифторированные циклогексадиеноны, которые легко могут быть модифицированы [2]. Большой интерес к полифторсодержащим циклогексадиенонам связан с их высокой и разнообразной реакционной способностью, которая обусловлена наличием в этих соединениях нескольких реакционных центров: подвижных атомов фтора при двойной связи, 1,3-диеновой системой в 2,4-циклогексадиенонах, карбонильной группы и реакционноспособного заместителя при sp3-гибридизованном атоме углерода.
Показано, что наиболее эффективными методами модификации полифторированных циклогексадиенонов являются нуклеофильные и фотохимические реакции, а также циклоприсоединение.
Синтез полифторированных циклогексадиенонов
Полифторированные циклогексадиеноны с различными заместителями в геминальном узле могут быть получены с хорошими выходами из полифторфенолов и нафтолов или их солей галоидированием [3] или окислением [4-10]. (Схема 1)

Схема 1
Для получения полифторированных циклогексадиенонов с фенильной группой при насыщенном атоме углерода был найден новый удобный метод селективного окислительного орто-арилирования перфторированных фенолов и нафтолов [11], заключающийся вовзаимодействии соотвествующих фенолятов и нафтолятов щелочных металлов с PhPb(OAc)3.
В случае пентафторфенолята натрия реакция не останавливается на стадии образования циклогексадиенона 1, а идет замещение нуклеофильноподвижного атома фтора в положении 3 на пентафторфеноксильную или гидрокси группу, что приводит в конечном итоге к циклогексадиенонам 2 и 3 [11] (Схема 2).

Схема 2
Реакции гептафтор-1-нафтолята натрия или калия с ArPb(OAc)3 и Ph2Pb(OAc)2 дают соответствующие 2-арил-1-оксогептафтор-1,2-дигидронафталины 4. (Схема 3).
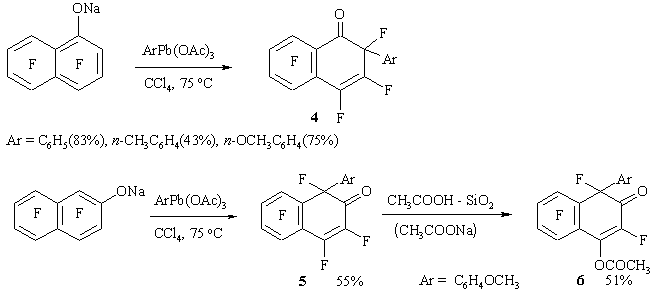
Схема 3
Гептафтор-2-нафтолят натрия реагирует с п-анизилтриацетатом свинца, образуя смесь с преимущественным содержанием соединения 5, которое после хроматографии на силикагеле, дезактивированном уксусной кислотой, дает 2-оксодигидронафталин 6 с выходом 51%.
Нуклеофильное замещение и восстановление
Реакции нуклеофильных реагентов с циклогексадиенонами, содержащими атомы галогена только у насыщенного атома углерода, приводят, как правило, к восстановлению их до производных фенола или замене галогена с образованием соответствующих замещенных циклогексадиенонов [12,13].
В отличие от этого, полифторированные циклогексадиеноны легко реагируют с нуклеофильными реагентами с заменой одного или двух атомов фтора при двойных связях, что является следствием как высокой реакционной способности соединений с фторированной двойной связью в нуклеофильных реакциях, так и активации двойной связи ее сопряжением с карбонильной группой [14]. Под влиянием карбонильной группы в полифторированных 2,4-циклогексадиенонах быстрее замещается атом фтора в положении 3, чем в положении 5, что согласуется с данными расчетов распределения зарядов в полифторированных 2,4-циклогексадиенонах методом МО [15]. В полифторированных 2,5-циклогексадиенонах эффект карбонильной группы на делокализацию заряда такой, что положения 3 и 5 являются более активными в нуклеофильных реакциях, чем положения 2 и 6. Примеры таких реакций, которые, как правило, идут с высокими выходами, приведены на схеме 4 [16-19]. (Схема 4).
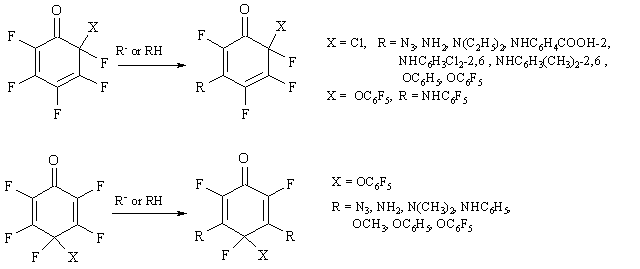
Схема 4
Надо отметить, что пентафторфеноксильная группа в положении 3 полифторированного 2,4-циклогексадиенона 2 легко замещается в мягких условиях нуклеофильными реагентами. Например, кипячение циклогексадиенона 2 с метанолом приводит к образованию соответствующего метоксипроизводного 7 [19]. (Схема 5).

Схема 5
Общим свойством циклогексадиенонов, содержащих галоген у насыщенного атома углерода, является их способность превращаться в фенолы при восстановлении. Когда у насыщенного атома углерода находится два атома галогена - фтор и хлор, при восстановлении отщепляется в первую очередь атом хлора. Использование этого метода для синтеза полифторированных фенолов наиболее выгодно в комбинации с первоначальным нуклеофильным замещением атома фтора у двойной связи полифторированных циклогексадиенонов, что наглядно иллюстрируют примеры [11,16,17,20] на схеме 6.
Метод, предложенный для получения фторсодержащих фенолов последовательностью вышеупомянутых реакций, представляет собой пример общей стратегии синтеза полифункциональных ароматических соединений. На первой стадии полифторированный фенол превращается в соответствующий циклогексадиенон, который легко и селективно можно модифицировать нуклеофильным замещением атома фтора, а затем модифицированный таким образом циклогексадиенон восстанавливается до полифторированных фенолов, содержащих различные заместители.

Схема 6
Нуклеофильные реакции циклогексадиенона 8 с фенолами [21] и тетрафторрезорцином [22] были использованы для синтеза некоторых полифторированных полифениловых эфиров с нитро, амино и карбоксильными группами, разветвленных и линейных полифторированных полифениловых эфиров с пятью и восемью карбоциклическими фрагментами в молекуле.
Циклогексадиенон 8 реагирует с двумя эквивалентами пентафторфенолята натрия при комнатной температуре с образованием 3,5-замещенного циклогексадиенона 9. Последний изомеризуется при 50-70°С в диенон 10а. Используя четыре эквивалента фенола в присутствии карбоната калия при 70°С, можно получить циклогексадиеноны 11a-f с феноксильной группой, и в ароматической и в диенонной части молекулы (Схема 7). Перегруппировка циклогексадиенона 9 осуществляется, вероятно, по внутримолекулярному механизму. Косвенным аргументом в пользу такого механизма может служить отсутствие в продуктах реакции соединений с орто-хиноидной структурой (достаточно стабильных в данных условиях [23]), которые должны были образовываться, если механизм изомеризации включает диссоциацию-рекомбинацию феноксильных радикалов.
Циклогексадиеноны 11a-f могут быть восстановлены до 3,5-диарилокси фенолов 12a-f, которые образуют полифторированные полифениловые эфиры 13a-c при реакциях с гексафторбензолом или 13d-f в реакциях с октафтортолуолом [22].
Два эквивалента 2,3,4,5,6-пентафтор-6-хлор-2,4-циклогекса-диенона 14 реагируют с тетрафторрезорцином при комнатной температуре, давая с выходом 90%, 1,3-бис(4-хлортетрафтор-3-оксо-1,5-циклогексадиенилокси)-тетрафторбензол 15.
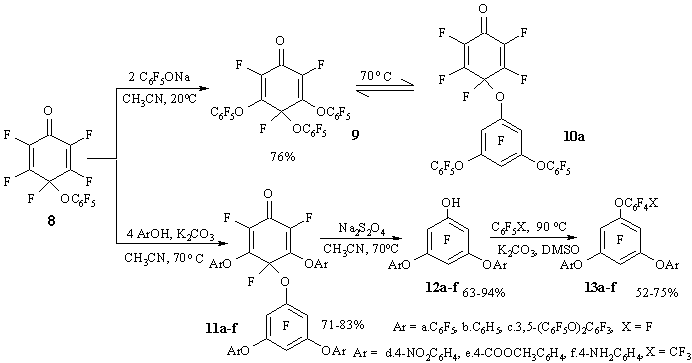
Схема 7
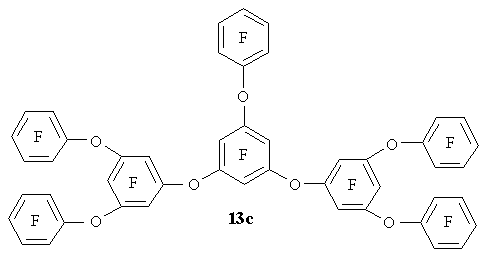
Восстановление соединения 15 дитионитом натрия приводит к тетрафтор-1,3-бис-(тетрафтор-3-гидроксифенокси)бензолу 16 [21], который был также получен в реакции циклогексадиенона 8 с тетрафторрезорцином. Последовательным восстановлением соединения 15 до 16, получением динатриевой соли последнего и ее реакцией с октафтортолуолом получен полифторированный полифениловый эфир 17 (Схема 8).

Схема 8
Реакция такого нуклеофила как трифенилфосфин с полифторциклогексадиеноном 2 приводит к интересному и неожиданному результату [24]. Основной продукт этой реакции циклогексендион 19, структура которого подтверждена данными рентгеноструктурного анализа (РСА), содержит одну CF2 и две карбонильные группы. Кроме того, фенильная и пентафторфеноксильная группы в этом соединении находятся в соседних положениях, тогда как в исходном циклогексадиеноне 2 они занимают положения 6 и 3 соответственно (Схема 9).

Схема 9
На схеме 10 представлена вероятная последовательность реакций, приводящая к образованию соединения 19.
На первой стадии трифенилфосфин замещает пентафторфеноксильную группу в положении 3 исходного циклогексадиенона 2. Далее пентафторфеноксильный анион замещает атом фтора в положении 5 нового циклогексадиенона с образованием фторида фосфония А, изомеризующегося через стадию образования оксирана в соль фосфония В и затем в цвиттерион 18 с двумя CF2 группами. Это соединение, по-видимому, нестабильно и при присоединении воды и отщеплении HF дает стабильный дион 19. (Схема 10)
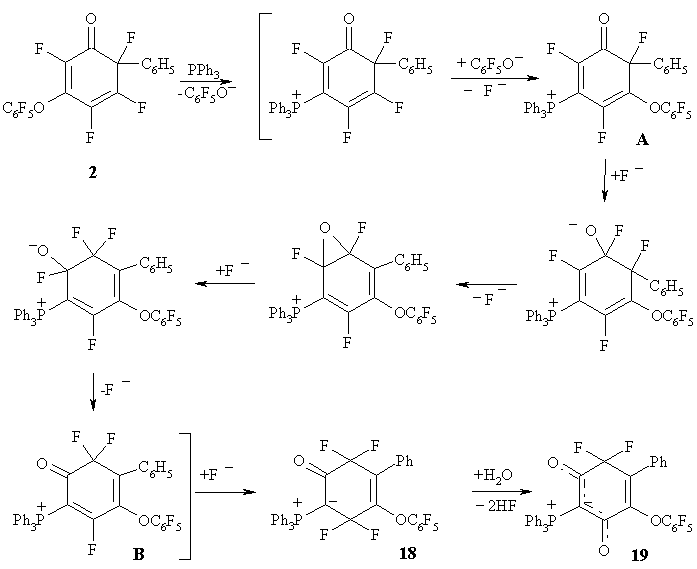
Схема 10
Реакции с участием карбонильных групп
Реакции с фенилгидразинами
Известно, что реакции нефторированных циклогексадиенонов с нуклеофильными реагентами осуществляются как с участием двойных связей, так и карбонильной группы [25].
Превращения по карбонильной группе циклогексадиенонов наиболее полно представлены реакциями с производными гидразина [26] и металлорганическими соединениями [25,27].
Исследование реакций полифторированных циклогексадиенонов с производными гидразина и металлорганическими соединениями позволяет оценить относительную реакционную способность двух электрофильных центров этих соединений: фторированной двойной связи и карбонильной группы.
Циклогексадиенон 8 реагирует с фенил- и пентафторфенилгидразином в ацетонитриле, давая циклогексадиенон 20 –продукт нуклеофильного замещения атома фтора при двойной связи в исходном диеноне 8, который в результате диспропорционирования превращается в смесь соответствующих 3-арилазотетрафтор-фенолов 21a,b и пентафторфенол в равном соотношении. Участие карбонильной группы полифторированных циклогексадиенонов в этой реакции не наблюдается. (Схема 11)
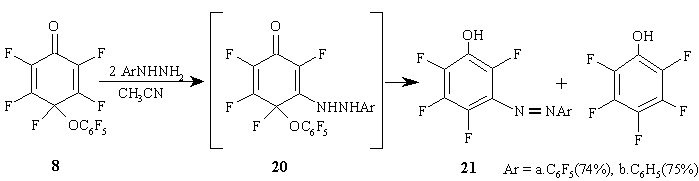
Схема 11
Поскольку известно, что кислоты катализируют реакцию арилгидразинов по карбонильной группе циклогексадиенонов [28,29], было изучено взаимодействие полифторированных циклогексадиенонов с комплексами фенил- и пентафтофенилгидразина и хлористого алюминия.
Циклогексадиенон 8 реагирует с этими реагентами только с участием карбонильной группы, давая соответствующие азобензолы 22-24 [30]. При образовании азобензолов в качестве уходящей группы из геминального узла циклогексадиенонов выступает как атом фтора, так и пентафторфеноксильная группа. В реакции с комплексом хлористого алюминия и пентафторфенилгидразина основной продукт реакции образуется за счет элиминирования атома фтора, тогда как для комплекса фенилгидразина примерно в равном соотношении реализуются оба возможных пути реакции. (Схема 12)
Такое различие в поведении фенил- и пентафторфенилгидразина является, вероятно, результатом взаимодействия в переходном состоянии ароматического заместителя диенона и ароматического кольца гидразина. Весьма вероятно [30], что первоначально образующиеся комплексы диенон - арилгидразин - хлористый алюминий имеют структуру "сэндвича", в которых арилгидразин может быть расположен как со стороны ароматического фрагмента, находящегося в геминальном узле циклогексадиенона A, так и с противоположной стороны B. Комплексы А и В дают в дальнейшем соответствующие интермедиаты типа C и D. Пентафторфеноксильная группа будет уходящей в первом случае C и атом фтора - во втором D [30].
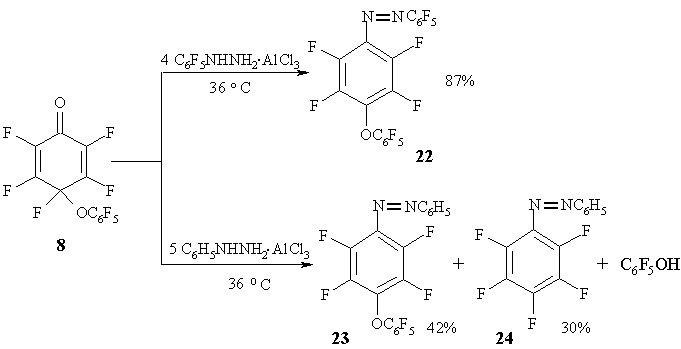
Схема 12
Для интермедиатов с нефторированным фенилгидразином типа С возможна дополнительная стабилизация за счет Π-взаимодействия между фторированным и нефторированным ароматическими кольцами (образование Π-комплексов между фторированными и нефторированными ароматическими соединениями известно [31]), что приводит, в конечном счете, к отщеплению пентафторфеноксильной группы из геминального узла диенона. В случае же фторарилгидразинов взаимодействие между фторированными ароматическими кольцами гидразина и диенона приводит к дестабилизации комплекса С и реализуется переходное состояние D, в котором в большей степени осуществляется отрыв атома фтора. (Схема 13)
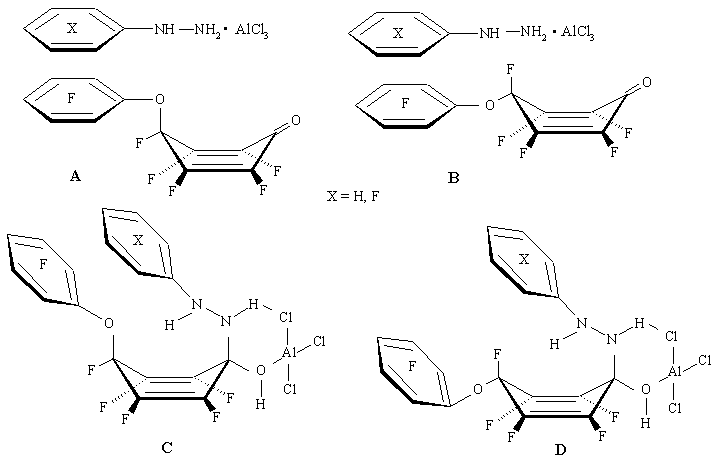
Схема 13
Комплексы арилгидразинов с хлористым алюминием могут быть использованы для синтеза различных фторированных азосоединений 25-27, как показано на схеме 14.
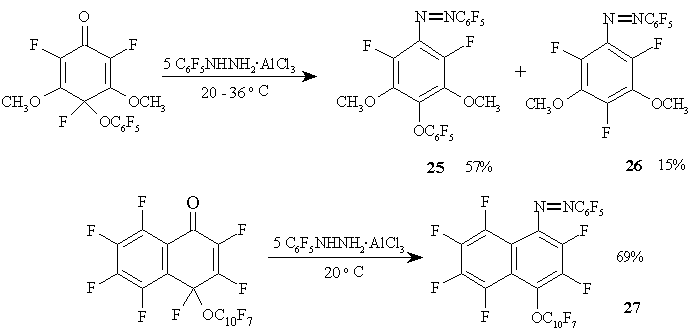
Схема 14
Реакции с металлорганическими соединениями
Реакции циклогексадиенона 8 с н-бутиллитием и н-бутилмагний-бромидом также идут по карбонильной группе, давая 1-бутил-4-пентафтор-фенокси-2,3,4,5,6-пентафтор-циклогекса-2,5-диен-1-ол 28 [30]. (Схема 15)
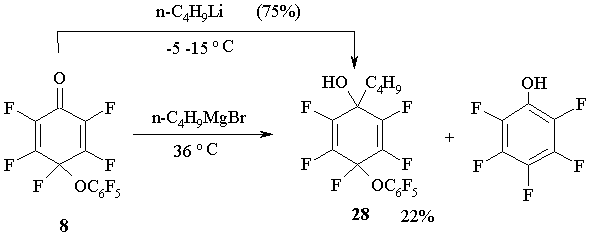
Схема 15
Таким образом, полифторированные 2,5-циклогексадиеноны могут реагировать с нуклеофильными реагентами исключительно по карбонильной группе, несмотря на наличие в полифторированных циклогексадиенонах нулеофильно подвижных атомов фтора у двойной связи.
Фотохимические превращения
В отличие от фотолиза нефторированных фенилциклогексадиенонов, при котором идут превращения, не затрагивающие карбонильную группу [32-35] фотохимические реакции полифторированных фенилциклогексадиенонов в растворе гексана протекают с участием карбонильной группы и фенильного фрагмента, находящегося в геминальном узле, приводя к образованию полифторированных производных фурана: дибензофурану 29 и бензонафтофурану 30 [36] (Схема 16).
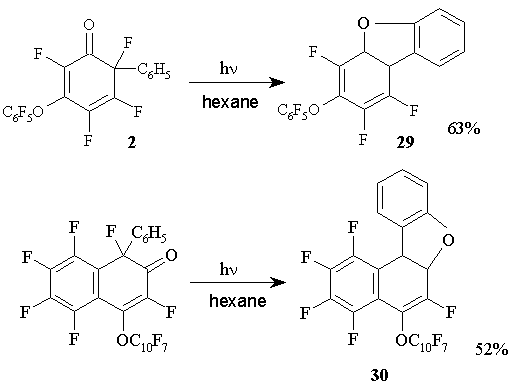
Схема 16
При фотолизе раствора 2-толил-1-оксогептафтор-1,2-дигидронафталина 31 в хлороформе основным продуктом также является фторированное производное бензонафтофурана 32, Наряду с этим образуются небольшие количества продукта миграции атома фтора: 2-толил-1-оксогептафтор-1,4-дигидронафталин 33.Кроме того, это единственная для изученных полифторциклогексадиенонов реакция, в которой отмечено характерное для углеводородных аналогов образование циклопропанового производного 6a-толилгептафтор-1,1a-дигидро-циклопропа [a]инденона (34). (Схема 17)
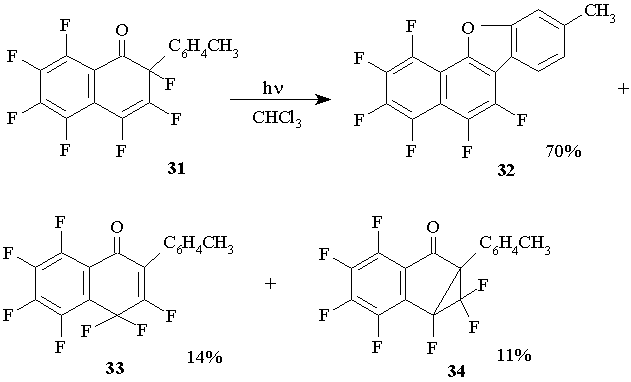
Схема 17
Реакции циклоприсоединения полифторированных циклогексадиенонов
Реакции 1,3-циклоприсоединения диазометана и его производных
Известно, что алкилзамещенные 2,4-циклогексадиеноны реагируют с диазометаном и алкил- или фенилдиазометанами только по двойным углерод-углеродным связям, образуя полициклические пиразолы и циклопропаны [37-40].
Основными продуктами реакции циклогесадиенона 14 с фенилдиазометаном в ацетонитриле (добавление раствора фенилдиазометана к раствору диенона 14) являются изомерные 3-хлор-1,3,4,5,6-пента-фтор-7-фенилбицикло- [4.1.0]гепт-4-ен-2-оны (35a и 35b, 62:38), образованные с участием только двойной связи. Кроме того, с очень низким выходом (5%) были получены изомерные 6-хлор-3a,4,5,6,7a-пента-фтор-3,3’-дифенил-3a,6,7,7a-тетрагидро-спиро [3H-индазол-7,2’-оксираны] (36a и 36b, 67:33).
В отличие от этого, 6-хлор-2,3,4,5,6-пентафтор-2,4-циклогексадиенон 14 реагирует с диазометаном в эфире при 0oC, как по карбонильной группе, так и по двойной связи с образованием смеси двух изомеров (58:42) 6-хлор-3a,4,5,6,7a-пентафтор-3a,6,7,7a-тетрагидроспиро [3H-индазоло-7,2’-оксирана] 37a,b с выходом 52 % [41]. (Схема 18)
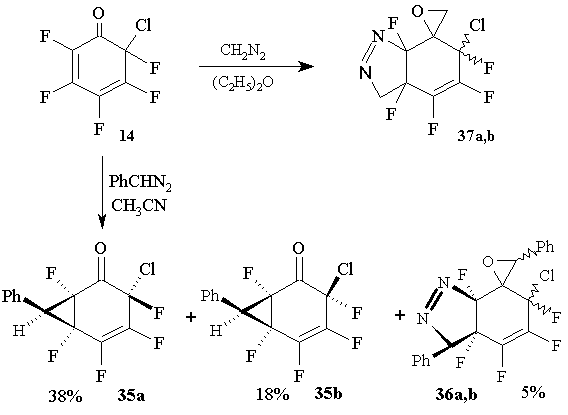
Схема 18
Реакции 6-хлор-3-(пентафторфенокси)-2,4,5,6-тетрафтор-2,4-циклогексадиенона 38 и циклогексадиенона 2 с фенилдиазометаном в ацетонитриле также дают производные циклопропана 39a и 39b (67:33) или 40a и 40b (83:17), соответственно, и пентафторбензилфениловый эфир 41 (~10%). При этом в качестве продуктов конкурентных реакций образуются заметные количества (Z)- и (E)-стильбенов 42. В этих реакциях бициклотетрагидроиндазолов типа 36 и 37 обнаружено не было. (Схема 19)
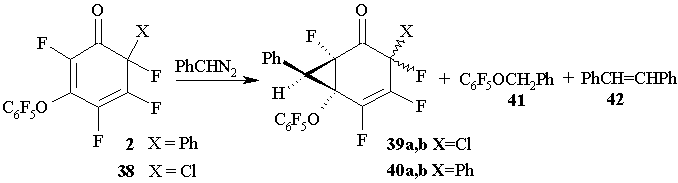
Схема 19
Для образования циклопропановых производных в реакциях полифторированных цикло-гексадиенонов 2,14 и 38 с фенилдиазометаном был предложен следующий механизм. (Схема 20)
Цвиттер-ион 44, образующийся на первой стадии из диенонов 2, 14 или 38, через переходное состояние, подобное 43, стабилизируется либо за счет элиминирования азота с последующей циклизацией, приводящей к образованию производных циклопропана 35a,b, 39a,b и 40a,b,либо в результате элиминирования пентафторфенола,взаимодействие которого с фенилдиазометаном приводит к образованию пентафторфенилбензилового эфира 41. Вероятность последней реакции была проверена независимым экспериментом. Кроме того, известно, что пентафторфеноксильная группа в положении 3 полифторированных циклогексадиенонов может быть легко замещена различными нуклеофильными реагентами [24].

Схема 20
Данные РСА бициклогептенонов 35a и 35b показывают, что циклоприсоединение циклогексадиенона 14 и фенилдиазометана идет с высокой селективностью: оба изомера 35a и 35b имеют эндо-конфигурацию, что находится в согласии с предложенной выше схемой.
Интересно [42], что тетрафтор-п-бензохинон реагирует с диазометаном исключительно по карбонильной группе, давая тетрафтор-2,5-циклогексадиен-1-он-4-спиро-2’-оксиран 45, наряду с небольшим количеством пентациклического соединения 46 - продукта реакции с участием обеих двойных связей и карбонильных групп тетрафтор-п-бензохинона. (Схема 21)
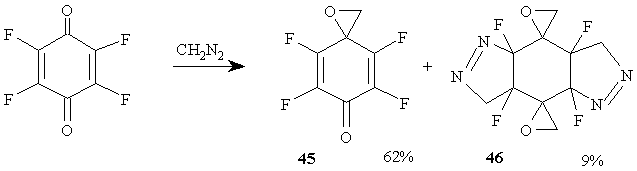
Схема 21
Полифторированные 2,5-циклогексадиеноны 8,47-49, являющиеся достаточно близкими аналогами тетрафтор-п-бензохинона, также реагируют с диазометаном по карбонильной группе давая с высокими выходами (70 – 98%) смеси двух диастереомерных полифторированных 1-оксаспиро [2.5]окта-4,7-диенов 50a-52a и 50b-52b, а также 53 [43](Схема 22).

Схема 22
Продукт присоединения диазометана по двойной связи полифторированных 2,5-циклогексадиенонов 54 образуется лишь в следовых количествах.
Таким образом, полифторированные 2,4-циклогексадиеноны в отличие от нефторированных циклогексадиенонов, реагируют с диазометаном как по двойным связям, так и по карбонильной группе с образованием изомерных фторсодержащих тетрагидро-спиро [индазол-оксиранов], отличающихся пространственным расположением атомов галогена CFCl-группы. С фенилдиазометаном полифторированные 2,4-циклогексадиеноны реагируют преимущественно по фторированной двойной связи, давая с высокой стереоселективностью изомерные фторсодержащие фенилбицикло [4.1.0]гептеноны, имеющие эндо-конфигурацию. В то же время полифторированные 2,5-циклогексадиеноны реагируют с диазометаном преимущественно по карбонильной группе.
Замена карбонильной группы на реакционноспособный оксирановый цикл в полифторированных 2,5-циклогексадиенонах существенно расширяет их синтетические возможности. Одной из интересных и широко известных реакций оксиранов является присоединение алкил- или арилизоцианатов, приводящая к образованию 2-оксазолидинонов [44,45].
Полифторированные спирооксираны 50,51 реагируют с арил- или алкилизоцианатами в присутствии солей лития или натрия с образованием фторсодержащих дигидро-1,3-бензоксазол-2(3Н)-онов 55 [43] (Схема 23).
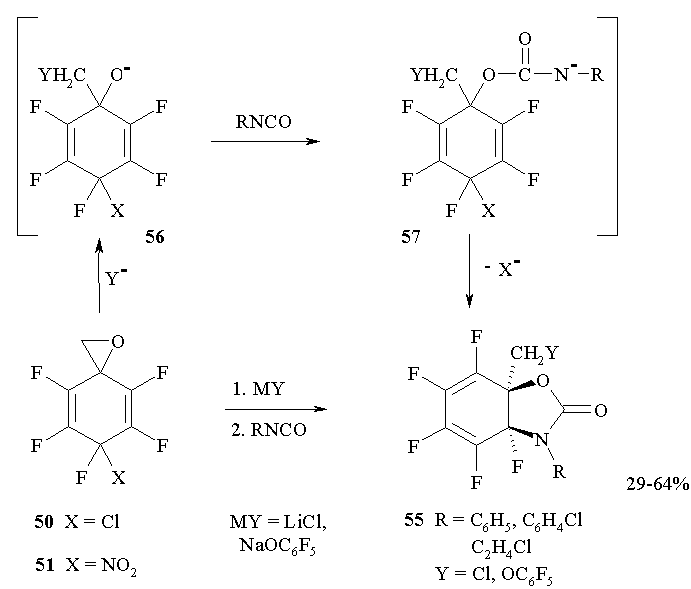
Схема 23
При этом реакции спирооксирана 50 идут в присутствии каталитических количеств LiCl, в то время как в реакциях оксирана 51 соли лития или натрия выступают в качестве реагентов и используются в эквимолярных количествах. Это находится в согласии с предположением о первичном разрыве связи CH2-O при действии нуклеофила (Cl¯ или ¯OC6F5), приводящем к образованию алкоголята 56. Присоединение к изоцианату аниона 56 дает амбидентный ион 57, которыйциклизуется исключительно по С=С связи с элиминированием Х¯ из геминального узла CFX и образованием бензоксазолонов 55.
Интересные результаты получены при попытке раскрытия оксиранового цикла соединений 51,52 под действием кислот Льюиса [46,47]. Известно, что взаимодействие оксиранов с ароматическими соединениями в присутствии кислот Льюиса приводит к электрофильному оксиалкилированию [48,49]. Мы обнаружили, что реакции полифторированных спирооксиранов 51,52 с бензолом, толуолом, мезитиленом и анизолом в присутствии AlCl3 и α-пиколина приводят к образованию фторсодержащих биарилов. При этом оксиран 51, теряя нитрогруппу, выступает в качестве пентафторфенилирующего агента, давая бифенилы 58a-58d. В то же время, оксиран 52,имеющий в геминальном узле OC6F5 группу, сохраняет ее в продуктах реакции, приводя к биарилам 59a,b. Фактически оксираны 51,52 выступают для реакций электрофильного замещения в ароматическом ядре в качестве «синтетического эквивалента» полифторированных арильных катионов. (Схема 24)

Схема 24
Можно предположить, что образующийся на первой стадии комплекс оксирана (51 или 52) с AlCl3 “A” раскрывается с образованием аренониевого иона “B”. Взаимодействие последнего с ароматическим субстратом, протекающее, вероятно, через промежуточный цвиттер-ион “C”, приводит в конечном итоге к образованию полифторированных биарилов 58a-d, 59a,b, хотя нельзя отрицать возможности прямого взаимодействия комплекса “A” с ароматическим субстратом.
Реакции [4+2] циклоприсоединения с производными ацетилена
Полифторированные 2,4-циклогексадиеноны легко вступают в реакции [4+2] циклоприсоединения с такими диенофилами как производные ацетилена, содержащие арильные, алкильные и гидроксиалкильные группы, давая с высокими выходами (75-96%) бицикло [2,2,2]октадиеноны 60 [19,50-52]. Реакции идут в мягких условиях при кипячении в бензоле, толуоле или четыреххлористом углероде. Циклоприсоединение протекает с высокой регио- и стереоспецифичностью с образованием только изомеров 60, в которых заместитель R1=H для реакций c несимметричными ацетиленами, что согласуется с распределением электронной плотности в диеновой части исходного 2,4-циклогексадиенона и ацетилене (Схема 25)

Схема 25
Данные рентгеноструктурного анализа подтверждают [52] высокую стереоселективность реакций Дильса-Альдера полифторированных циклогексадиенонов с ацетиленами. Конфигурация sp3-гибридизованного атома углерода с атомом фтора и заместителем X не зависит от природы этого заместителя: атом фтора всегда ориентирован в сторону связи, образованной за счет присоединения диенофила. Проведенные методом молекулярной механики (MM) [52] расчеты двух эпимерных аддуктов с различным расположением атомов фтора и хлора при sp3-гибридизованном атоме углерода показывают, что высокая стереоселективность реакции связана не с термодинамической стабильностью образующихся аддуктов, а является, скорее всего, результатом меньшего затруднения атаки диенофилом циклогексадиенона со стороны атома фтора по сравнению с атакой со стороны других геминальных заместителей, таких как хлор, фенил или пентафторфеноксильная группа [52].
Интересный результат был получен в реакции циклоприсоединения 3-азидо-тетрафтор-6-хлор-2,4-циклогексадиен-1-она 61. Нагревание этого диенона с фенилацетиленом в CCl4 при 70°C дает в качестве основного продукта 4-оксо-2-фенил-3,5,6,7-тетрафтор-5-хлор-бицикло [4.1.0]гепт-2-ен-7-карбонитрил 62 [19]. Циклопропановое производное 62 является продуктом превращения циклоаддукта 63, образование которого было зафиксировано методом 19F ЯМР при проведении реакции при комнатной температуре. (Схема 26)

Схема 26
Фосфаалкины - гетероаналоги ацетилена также вступают в реакцию [4+2] циклоприсоединения с полифторированными циклогексадиенонами [53]. Ранее реакции [4+2] циклоприсоединения фосфаалкинов с циклическими 1,3-диенами использовались для синтеза циклических фосфаалкенов, в частности, фосфаароматических соединений [54,55]. Как правило, промежуточные бициклические аддукты этих реакций выделить не удавалось [56].
Нами при нагревании циклогексадиенона 2 с бис(изопропил)аминофосфаэтином в растворе СH2Cl2 от -196 °C до комнатной температуры с количественным выходом был получен только один изомерный бициклический аддукт 64 [53]. (Схема 27)

Схема 27
Химический состав и структура аддукта 64 были определены элементным анализом и спектроскопическими исследованиями (МС, ЯМР 1H, 19F, 31P, 13C).
Интересно, что в отличие от этой реакции взаимодействие циклогексадиенона 2, с трет-бутилфосфаэтином приводит к образованию смеси трех соединений 65a,b и 66 в соотношении 90:4:6. Данные 31P ЯМР спектроскопии позволяют заключить, что в смеси продуктов реакции региоизомер 65 присутствует в виде смеси двух стереомеров, а региоизомер 66 – в виде одного. Реакция с трет-бутилфосфаэтином идет с заметно более низкой скоростью, так как полное превращение циклогексадиенона 2 достигается при нагревании смеси реагентов в течение двух дней при 60 °C. (Схема 27)
Бициклические аддукты 64, 65a,b и 66 являются устойчивыми соединениями в твердом состоянии и в обычных органических растворителях и не вступают с избытком фосфаалкина в характерную для 2-фосфабицикло [2.2.2]окта-2,5-диена гомореакцию Дильса-Альдера [57]. Однако для 65a в растворе хлороформа наблюдается внутримолекулярное [2+2] циклоприсоединение инициированное, вероятно, рассеянным дневным светом. Аддукт 65а при выдерживании при комнатной температуре в течение недели изомеризуется на 60% в соединение 67. (Схема 28)

Схема 28
Тетрациклическая структура соединения 67 была предложена на основе анализа данных спектров ЯМР. Наблюдаемый значительный сдвиг в сильное поле сигнала 31P (Δδp 304.1 м.д.), вызванный валентной изомеризацией 65a (δp = 217.7 м.д.) в 67 (δp = -86.4 м.д.), находится в соответствии с величиной сдвига Δδp 445 м.д., наблюдаемого при фотохимической трансформации 2-дюар-фосфина в соответствующее производное фосфопризмана [58].
Полифторированные циклогексадиеноны вступают в реакции [4+2] циклоприсоединения с таким диенофилом как дегидробензол [59]. Последний был получен in situ из о-аминобензойной кислоты и изоамилнитрита [60-62]. (Схема 29)
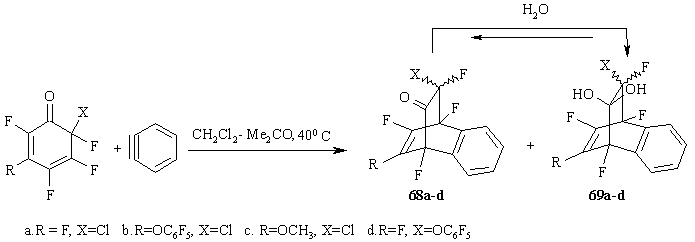
Схема 29
Продукты реакции, полученные с невысокими выходами (26-37%) представляют собой смесь двух соединений 68a-d и 69a-d. Анализ спектров 19F ЯМР и 13C ЯМР этих соединений позволил заключить, что соединения 69a-d являются гидратированными формами циклоаддуктов 68a-d, образующиеся, вероятно, с участием воды, присутствующей в растворителе.
Реакции [4+2] циклоприсоединения с алкенами
Реакции полифторированных циклогексадиенонов с алкенами [63] приводят к образованию с хорошими выходами (84-97%) бициклических аддуктов 70a-f. С большинством алкенов эти реакции идут с высокой региоселективностью, подобно реакциям с ацетиленами [52], исключением являются реакции с 1-гексеном и аллилбензолом, которые дают равную смесь двух изомерных циклоаддуктов 70a,b и 71a,b, что является, вероятно, следствием слабой поляризации двойной связи в этих алкенах. (Схема 30)
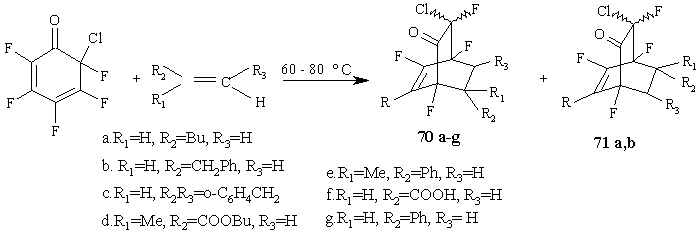
Схема 30
Реакции циклогексадиенона 14 с α-фторстиролом 72a и α-фтор-4-хлорстиролом (72b) в кипящем бензоле дают продукты [4+2] циклоприсоединения в виде равной смеси двух изомеров - (эндо-73a,b и экзо-73a,b) [64]. Аналогично, но в более жестких условиях (толуол, 110°С), протекает реакция между циклогексадиеноном 2 и α-фторстиролом 72a, давая два изомерных бициклических аддукта (эндо-74 и экзо-74) в близкой пропорции. (Схема 31)
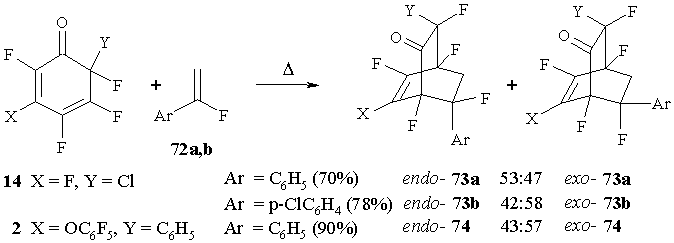
Схема 31
В реакциях циклогексадиенонов 2 и 14 с α-фторстиролами 72a,b, также как для реакций с ацетиленами, наблюдается высокая стереоселективность: атом фтора CFX группы в бицикло [2.2.2]октенонах 73 и 74 ориентирован в сторону новой связи, образованной при присоединении α-фторстирола 72a (данные РСА для эндо-73a, эндо- и экзо-74) [64].
Попытка осуществить реакцию 2,4,5,6-тетрафтор-3-метокси-6-фенил-2,4-циклогексадиенона 7 с α-фторстиролом 72a была неудачна. Вместо бициклических аддуктов в реакции образуется только продукт 1,3-сдвига атома фтора: 2,4,4,5-тетрафтор-3-метокси-6-фенил-2,5-циклогекса-диенон 75. (Схема 32)
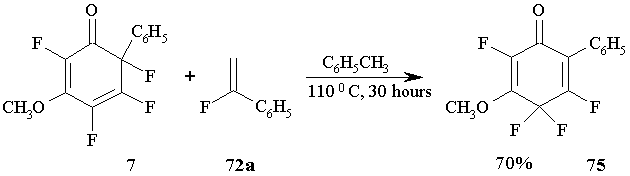
Схема 32
Известно, что β-фторстирол ведет себя в реакции с 1,3-дифенилизобензофураном как менее активный диенофил, чем α-фторстирол [65]. Реакции транс-β-фторстиролов 76a-d с полифторированными 2,4-циклогексадиенонами также протекают медленнее, чем таковые с α-фторстиролами. Однако, кипячение циклогексадиенона 14 с транс-β-фторстиролами 76a-d в толуоле приводит к образованию с выходом 75-79% двух бициклических аддуктов, которые являются эндо-транс-77 и экзо-транс-77 изомерами с преобладанием во всех случаях эндо-транс-изомеров. (Схема 33)
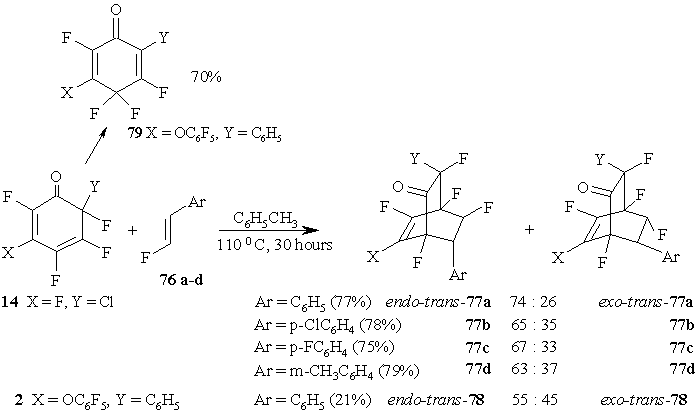
Схема 33
Циклогексадиенон 2 показывает невысокую реакционную способность при взаимодействии с транс-β-фторстиролом 76a, изомеризуясь преимущественно в 2,4,4,5-тетрафтор-3-(пентафторфенокси)-6-фенил-2,5-циклогексадиенон 79 продукты циклоприсоединения (эндо-транс-78 и экзо-транс-78) были получены с низкими выходами. (Схема 33)
В тех же условиях циклогексадиенон 7 дает только продукт изомеризации 75, как и в реакциисα-фторстиролом. (Схема 32)
Квантовохимические расчеты [64], проведенные методом РМ3 [66], находятся в согласии с полученными результатами по взаимодействию 2,4-циклогексадиенонов с α- и β-фторстиролами. Сравнение HOMO и LUMO энергий, а также орбитальных коэффициентов участвующих в процессе пар циклогексадиенон – стирол показывает, что их взаимодействие представляет собой согласованный процесс с обратным электронным запросом. Так, для пары циклогексадиенон 14 стирол 72а взаимодействие HOMOстирол - LUMOдиенон (Δ=6.94 Эв) более выгодно по сравнению с HOMOдиенон - LUMOстирол (Δ=10.33 Эв). Кроме того, орбитальные коэффициенты показывают очень эффективное перекрывание. Для реакции 14 с 76а наблюдается подобная картина: HOMOстирол - LUMOдиенон (Δ=6.76 Эв) и HOMOдиенон - LUMOстирол (Δ=10.33 Эв). Однако в этом случае орбитальное перекрывание менее эффективно. Для реакций 2 с 72a и 76a разность энергий HOMOстирол и LUMOдиенон становятся большими (7.30 Эв или 7.12 Эв, соответственно) и кроме того, степень перекрывания участвующих орбиталей становится меньше в реакции 2 с 72a и еще более уменьшается для реакции 2 с 76a. Как следствие в этом случае более вероятным становится побочный процесс - частичная изомеризация 2 в 79 в термических условиях (см. Схему 33).
Наконец, в реакциях метоксизамещенного циклогексадиенона 4 с 72a и 76a различия энергии вовлеченных орбиталей становится наибольшим (7.60 Эв или 7.42 Эв, соответственно) и циклоприсоединение в данных условиях не наблюдается, а идет лишь изомеризация 4 в 75 (см. схему 32).
Попытки вовлечь в реакцию Дильса-Альдера с полифторированными 2,4-циклогексадиенонами α-фтор-α,β-ненасыщенные кетоны, например, 4-фторокт-4-ен-3-он, были неудачны. В то же время циклогексадиенон 14 легко вступает в реакцию диенового синтеза с таким диенофилом как нафтохинон, давая с высоким выходом устойчивый аддукт 80 [67]. (Схема 34)
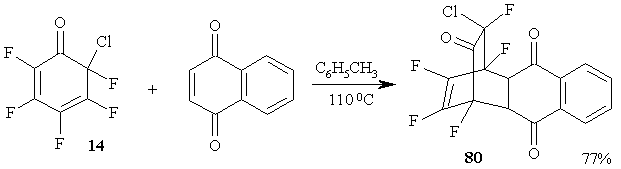
Схема 34
Превращения фторированных бицикло [2.2.2]октадиенонов
Фотохимические реакции
Фотолиз фторированных бицикло [2.2.2]октадиенонов 60, 68a с CFCl группой в соседнем положении к карбонильной группе при комнатной температуре в растворе хлороформа приводит к образованию, в качестве основных, тетрафторароматических соединений 81, вероятно, в результате элиминирования фторхлоркетена (FClC=C=O) [68]. При наблюдаемой конверсии бицикло [2.2.2]октадиенонов 100-75% выходы фторароматических соединений колеблются от 50 до 86% в расчете на прореагировавший бицикло [2.2.2]октадиенон. (Схема 35)

Схема 35
Селективное восстановительное дегалогенирование атомов галогена у sp3-гибридизованного атома углерода
Реакция бициклических аддуктов - 8-хлор-1,2,3,4,8-пентафтор-бицикло [2.2.2]окта-2,5-диенонов 60 с Zn в уксусной кислоте позволяет последовательно заменять на водород атомы хлора, а затем и фтора при sp3-гибридизованном атоме углерода [69]. Структура новых бициклических аддуктов 82a-d и 83a-d была приписана на основании спектральных и аналитических данных. Атомы фтора в других положениях остаются незатронутыми. (Схема 36)
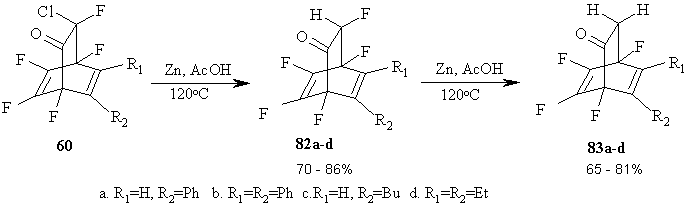
Схема 36
Надо заметить, что замена на водород атома хлора, находящегося в α-положении к карбонильной группе, в частности, в циклических кетонах, известна [70], но сведения о подобной замене атомов фтора в литературе найдены не были [71].
Гидролиз бициклических аддуктов в присутствии различных спиртов и аминов
Интересным свойством бициклических аддуктов, полученных в реакциях полифторированных циклогексадиенонов с производными ацетилена является их легкое расщепление при действии нуклеофильных реагентов с образованием фторсодержащих производных арилуксусных кислот 80-83. Специфическая особенность этих реакций - сохранение в ароматических соединениях структурных элементов мостика с CFCl и карбонильной группой [51]. Легко подвергаются ароматизации и бициклические аддукты, полученные после замены геминальных атомов хлора и фтора на водород 82,83 [69], давая с высокими выходами (85-95%) соответствующие фторированные арилуксусные кислоты 88,89. (Схема 37)
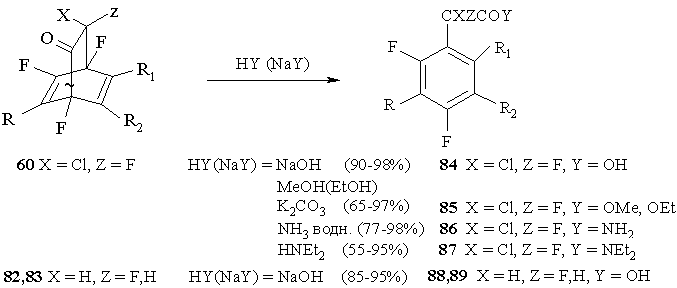
Схема 37
Обработка циклических аддуктов 68a-d, полученных из полифторированных 2,4-циклогексадиенонов и дегидробензола, щелочью или аммиаком в водном растворе диоксана приводит к образованию с высокими выходами фторсодержащих нафтилуксусных кислот 90a-d или их амидов 91a-d [59]. Надо заметить, что и в этих случаях ароматизация происходит с сохранением структурных элементов моста, содержащего карбонильную группу. (Схема 38)
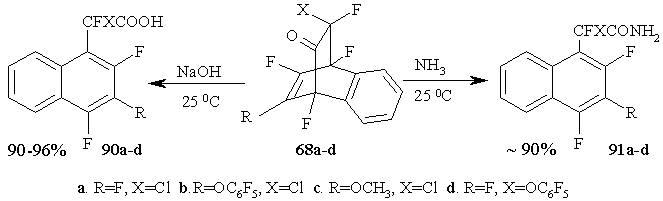
Схема 38
В отличие от этих реакций, некоторые фторированные и нефторированные аналоги упомянутых аддуктов ароматизируются только при действии сильных оснований с элиминированием мостика [72], содержащего карбонильную группу, или раскрываются с образованием неароматических циклических соединений [73] или вообще не реагируют с водной щелочью [72].
Механизм ароматизации полифторированных аддуктов Дильса-Альдера, очевидно, включает в себя расщепление связи C(4)-C(7) (путь А) под действием нуклеофила с образованием стабильного анионного σ-комплекса 92, который ароматизируется, элиминируя фторид-иона из геминального узла в цикле. (Схема 39)
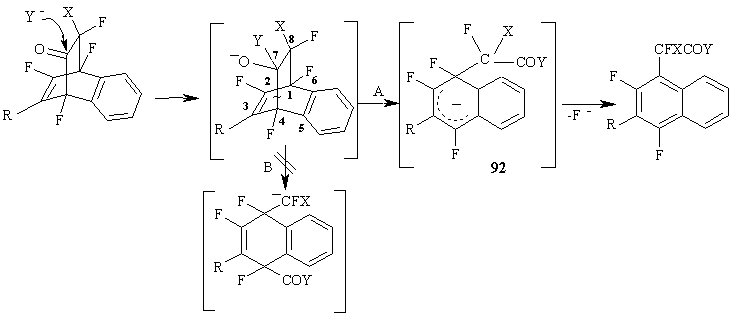
Схема 39
Нетрудно заметить, что реакции щелочного расщепления бициклических аддуктов, полученных в реакциях Дильса-Альдера полифторированных циклогексадиенонов и ацетиленов являются удобным методом синтеза фторпроизводных арилуксусных кислот. Изменяя заместители в ацетилене, в геминальном и 3 положениях полифторированного 2,4-циклогексадиенона, и используя различные спирты и амины на стадии ароматизации аддуктов, можно получить различные производные арилуксусных кислот, содержащих наряду с атомами фтора функциональные группы. Такой тип потенциально биологически активных соединений трудно получить другими методами.
Циклоаддукты, полученные в реакциях полифторированных циклогексадиенонов с алкенами 70 также легко подвергаются щелочному расщеплению в водном диоксане, давая содержащие фтор циклогексенкарбоновые кислоты 93 с хорошими выходами (65-95%) [63]. Конфигурация этих соединений была подтверждена данными рентгеноструктурного анализа двух образцов циклогексенкарбоновых кислот. (Схема 40)
Наиболее интересный аспект этой реакции связан с тем, что при действии гидроксид аниона на аддукты реакций полифторированных циклогексадиенонов с алкенами расщепляется связь C(7)-C(8) (путь В), а не связь C(4)-C(7) (путь А), как это имеет место для бициклических аддуктов, полученных при взаимодействии полифторированных циклогексадиенонов с ацетиленами и дегидробензолом (сравни Схема 39). При этом промежуточные анионы 94 с отрицательным зарядом на атоме углерода, связанном с фтором и хлором, стабилизируются присоединением протона с образованием циклогексенкарбоновых кислот [63].

Схема 40
Циклоаддукт 80, полученный при взаимодействии полифторированного циклогексадиенона 14 с 1,4-нафтохиноном при действии гидроокиси натрия при комнатной температуре подвергается одновременному расщеплению связи C-C во фрагменте O=C-CFCl и элиминированию фтористого водорода с образованием фторированной антрахинонкарбоновой кислоты 95. Этот новый метод является удобным путем к функциональным производным фторированных антрахинонов [67]. (Схема 41)

Схема 41
Заключение
Рассмотренные в настоящем обзоре синтетические превращения, основанные на использовании полифторированных циклогексадиенонов в качестве синтонов, позволяют получать путем фотолиза, нуклеофильных реакций, циклоприсоединения и несложных превращений продуктов этих реакций широкий набор фторированных соединений: производные полифениловых эфиров, бифенилы, арилуксусные кислоты, производные нафталина и антрахинона, содержащие карбоксильную группу, циклогексенкарбоновые кислоты, фторированные гетероциклические соединения, циклопропановые производные и бициклические фосфорсодержащие соединения. Дальнейшая трансформация и модификация продуктов этих реакций открывает возможность получения ранее недоступных фторорганических соединений различных структурных типов.
Новый подход особенно важен как метод синтеза фторированных производных арил- и диарилуксусных кислот, так как представители этих классов соединений являются основой многих лекарственных препаратов (пропанидид, диклофенак, спазмолитин, пафенцил, апрофен). При этом хорошо известно, что присутствие атомов фтора в фармацевтических препаратах усиливает их активность, повышает метаболическую стабильность, удлиняет их действие, и часто уменьшает их токсичность [74-76].
Подход, в котором полифторированные циклогексадиеноны могут использоваться как высокореакционные синтоны, открывает широкие перспективы синтеза недоступных физиологических активных фторированных арилуксусных кислот, содержащих функциональные группы. Такие синтезы осуществимы, благодаря возможности введения нужных функциональных групп на всех стадиях процесса синтеза этих кислот: нуклеофильным замещением атома фтора в положении 3 полифторированных циклогексадиенонов; использованием различных замещенных ацетиленов в реакциях циклоприсоединения; селективной заменой на водород атомов галоидов при sp3-гибридизованном атоме углерода бициклических аддуктов; гидролизом бициклических аддуктов с различными спиртами и аминами с образованием производных арилуксусных кислот.
Список литературы
2. Кобрина Л.С.// Изв. АН. Сер. хим. 2002. С. 1629-1649
3. Ахметова Н.Е., Штарк А.А., Штейнгарц В.Д.// Журн. орг. химии. 1973. Т. 9. С 1218- 1227
4. Кобрина Л.С., Ковтонюк В.Н., Якобсон Г.Г.// Журн. орг. химии. 1977. Т. 13. С. 1447- 1452
5. Ковтонюк В.Н., Кобрина Л.С., Якобсон Г.Г.// Изв. СО АН СССР, Cер. .хим. наук. 1984. вып. 2. № 5. С. 119-123
6. Kovtonyuk V.N., Kobrina L.S.,.Yakobson G.G.// J. Fluor.Chem. 1981. V. 18. P. 587-600
7. Kovtonyuk V.N., Kobrina L.S., Yakobson G.G.// J. Fluor.Chem. 1985. V. 28. P. 89-98
8. Кобрина Л.С., Попкова Н.В., Якобсон Г.Г.// Изв. СО АН СССР, Сер. хим. наук. 1976. вып. 3. № 7. С. 125-128
9. Кобрина Л.С., Попкова Н.В., Якобсон Г.Г.// Изв. СО АН СССР, Сер. хим. наук. 1976. вып. 5. № 12. С. 140-147
10. Попкова Н.В., Кобрина Л.С., Якобсон Г.Г. //Изв. СО АН СССР, Сер. хим. наук. 1978. вып. 5. № 12. С. 110-116
11. Kovtonyuk V.N., Kobrina L.S.// J. Fluor. Chem. 1993. V. 63. P. 243-251
12. Miller B.// J. Org. Chem. 1963. V. 28 P. 345-348
13. Pat. 3525756 US // Chem. Abstrs. 1970. V. 73. P. 98477
14. Sheppard W., Sharts C.// Organic Fluorine Chemistry. New-York : W. A. Benjamin, Inc. 1969
15. Somekawa K., Matsuo T., Kumamoto S.// Bull. Chem. Soc. Jpn. 1969. V. 42. P. 3499-3504
16. Ахметова Н.Е., Костина Н.Г., Маматюк В.И., Штарк А.А. Штейнгарц В.Д.// Изв. СО АН СССР, Сер. хим. наук. 1973. вып. 6. № 14. С. 86-100
17. Ахметова Н.Е., Костина Н.Г., Штейнгарц В.Д. //Журн. орг. химии. 1979. Т. 15. С. 2137-2147
18. Ковтонюк В.Н., Кобрина Л.С., Якобсон Г.Г.// Журн. орг. химии. 1988. Т. 24. С. 1952- 1959
19. Ковтонюк В.Н., Кобрина Л.С.// Журн. орг. химии. 2002. Т. 38. С. 196-201
20. Ахметова Н.Е., Штейнгарц В.Д.// Журн. орг. химии. 1977. Т. 13. С. 1277-1285
21. Ковтонюк В.Н., Кобрина Л.С.// Журн. орг. химии. 1991. Т. 27. С. 2289-2297
22. Ковтонюк В.Н., Кобрина Л.С.// Журн. орг. химии. 1999. Т. 35. С. 82-86
23. Ковтонюк В.Н., Кобрина Л.С., Якобсон Г.Г.// Журн. орг. химии. 1979.Т. 15. C. 1447- 1453 2
24. Grobe J., Le Van D., Wiese H., Krebs B., Läge M., Kobrina L.S.// Z. Naturforschung B. 1995. V. 50. P. 691-694
25. Waring A.J.// Advances in Alicyclic Chemistry. (Eds. Hart H. and Karabatsos G.J.). New York: Acad.Press. 1966. V. 1. 129 P.
26. Taylor E.C., Jagdmann G.E., McKillop A.// J. Org. Chem. 1978. V. 43. P. 4385-4387
27. Auwers K., Ziegler K.// Liebigs Ann. Chem. 1921. V. 425. P. 280-294
28. Bamberger E., Reber E.// Ber. Deutsch. Chem. Ges. 1907. V. 40. P. 2258-2274
29. Hecker E.// Chem. Ber. 1959. V. 92. P. 3198-3208
30. Ковтонюк В.Н., Кобрина Л.С.// Изв. АН. Сер. хим. 1996. C. 1778-1781
31. Gozzi F., Siegel J.S.// Pure Appl. Chem. 1995. V. 67. P. 683-689
32. Perst H., Dimroth K.// Tetrahedron. 1968. V. 24. P. 5385-5393
33. Greenland H., Pinhey J.T., Sternhell S.// J. Chem. Soc., Perkin Trans. 1. 1986. P. 1789-1795
34. Greenland H., Kozyrod R.P., J.T.Pinhey J.T.// J. Chem. Soc., Perkin Trans. 1. 1986. P. 2011- 2016
35. Carnduff J., Iball J., Leppard D.G., Low J.N.// J. Chem. Soc., Chem. Commun. 1969. P. 1218-1219
36. Kovtonyuk V.N., Kobrina L.S.// J. Fluor. Chem. 1994. V. 66. P. 219-221
37. Wessely F., Schinzel E., Spiteller G., Klezl P.// Monatsh. Chem. 1959. V. 90. P. 96-117
38. Spiteller G., Schmidt G., Budzikiewicz H., Wessely F.// Monatsh. Chem. 1960. V. 91. P. 129-138
39. Wessely F., Budzikiewicz H., Metlesics W.// Monatsh. Chem. 1959. V. 90. P. 121-133
40. Wessely F., Budzikiewicz H., Janda H.// Monatsh. Chem. 1960. V. 91. P. 456-464
41. Kovtonyuk V.N., Kobrina L.S., Gatilov Yu.V., Bagryanskaya I.Yu., Frölich R., Haufe G.// J. Chem. Soc., Perkin Trans. I. 2000. P. 1929-1933
42.Ковтонюк В.Н.,Кобрина Л.С.,Багрянская И.Ю.,Гатилов Ю.В.//Журн.орг.химии. 1999.Т. 35.С. 75-78
43. Kovtonyuk V.N., Kobrina L.S.,О.M.Kataeva, G.Haufe.// Eur. J. Org. Chem. 2005. P. 1178- 1183
44. Dyen M.E., Swern D.// Chem. Rev. 1967. V. 67. P. 197-246
45. Okumoto S., Yamabe S.// J. Comput. Chem. 2001. V. 22. 316-328
46. Ковтонюк В.Н., Кобрина Л.С., Петров Д.В. Хауфе Г.// Тезисы 7-й Всероссийской конференции «Химия фтора». Москва. 2006. Р. 148
47. Ковтонюк В.Н., Кобрина Л.С., Хауфе Г.// Изв. АН. Сер. хим. 2008. C. 1654-1656
48. Шорыгина Н.В.// Журн. общ. химии. 1951. Т. 21. С. 1273-1276
49. Hopff H., Koulen K.// Chem. Ber. 1952.V. 85. P. 897-900 3
50. Кобрина Л.С., Штейнгарц В.Д.// Журн. орг. химии. 1988.Т. 24.С. 1344-1345
51. Kobrina L.S., Bogachev A.A.// J. Fluor. Chem. 1993. V. 62. P. 243-258
52.Богачев А.А.,Багрянская И.Ю.,Рыбалова Т.В.,Гатилов Ю.В.,Кобрина Л.С.//Журн.общ.химии. 1996.Т. 66.С. 1324-1333
53. Grobe J., Le Van D., Broschk B., Kobrina L.S.// Tetrahedron Lett. 1993. V. 34. P. 4619-4622
54. Regitz M. In Multiple Bonds and Low Coordination in Phosphorus Chemistry. (Eds., Regitz M., Scherer O.J.). Stuttgart, New York: G.Thieme Verlag. 1990. P. 58
55. Märkl G., Jin Yu G., Silbereisen E.// Angew. Chem. Int. Ed. Engl. 1982. V. 21. P. 370-371
56. Annen U., Regitz M., Klugeb H.// Chem. Ber. 1990. V. 123. P. 935-937
57. Annen U., Regitz M.// Tetrahedron Lett. 1988. V. 29. P. 1681-1684
58. Blatter K., Rösch W., Vogelbacher U.J., Fink J., Regitz M.// Angew. Chem. Int. Ed. Engl. 1987. V. 26. P. 85-86
59. Богачев А.А., Кобрина Л.С., Штейнгарц В.Д.// Изв. АН. Сер. хим. 1994. P. 1634-1637
60. Del Mazza D., Reinecke M.C.// J. Org. Chem. 1988. V. 53. P. 5799-5805
61. Friedman L., Logullo F.M.// J. Am. Chem. Soc. 1963. V. 85. P. 1549
62. Gray A.C.G., Hart H.// J. Am. Chem. Soc. 1968.V. 90. P. 2569-2578
63. Богачев А.А., Мануйлов А.В., Кобрина Л.С.// Журн. орг. химии. 1996. Т. 32. С. 1016- 1021
64. Bogachev A.A., Kobrina L.S., Meyer O.G.L., Haufe G.// J. Fluor. Chem. 1998. V. 97. P. 135- 143
65. Ernet T., Haufe G.// Tetrahedron Lett. 1996. V. 37. P. 7251-7252
66. Stewart J.J.P.// MOPAC93. Tokyo: Fujitsu Limited. 1993. 414P
67. Богачев А.А., Кобрина Л.С.// Журн. орг. химии. 1997. Т. 33. С. 1433-1434
68. Богачев А.А., Кобрина Л.С.// Журн. орг. химии. 1997.Т. 33.С. 742-744
69. Bogachev A.A., Kobrina L.S.// J. Fluor. Chem. 1998. V. 92. P. 33-39
70. Brady W.T.// Tetrahedron. 1981. V. 37. P. 2949-2966
71. De Kimpe N., Verhe R.// The Chemistry ofa-Haloketones, a-Haloaldehydes and aHaloimines. Chichester: Wiley. 1988. 107P
72. Oku A., Matsui A.// Bull. Chem. Soc. Jpn. 1977.V. 50. P. 3338-3343
73. Михайлова И.Ф., Бархаш В.А.// Журн. орг. химии. 1970.Т. 6.С. 2325-2330
74. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications. (Eds., Filler R., Kobayashi Y., Yagupolskii L.M.). Amsterdam: Elsevier. 1993. 386P
75. Biomedical Frontiers of Fluorine Chemistry. (Eds., Ojima I., McCarthy J.R., Welch J.T.). Washington: ACS Symposium Series 639. 1996. 356P
76. Машковский М.Д.// Лекарственные средства. Т 1. Харьков: Торсинг. 1998. С. 543
Материал рекомендован к публикации членом редколлегии В.Е. Платоновым
Fluorine Notes, 2012, 84, 1-2
