Received: март, 2012
Fluorine Notes, 2012, 83, 9-10
Производные 5,5,6-трифтор-7-окса-бицикло[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты
К.Н.Герасимов, А.Ф.Елеев, В.С.Кузьмин, С.С.Хохлов
Федеральное государственное унитарное предприятие
«Государственный научно-исследовательский институт органической химии и технологии», 111024, Москва, шоссе Энтузиастов, 23
e-mail: dir@gosniiokht.ru
Аннотация. Методом рентгеноструктурного анализа установлено, что в реакции [2+4]-циклоприсоединения перфторакрилонитрила к фурану основным продуктом является экзо-изомер нитрила 5,5,6-трифтор-7-окса-бицикло[2.2.1]гепт-2-ен-6-карбоновой кислоты. На его основе синтезированы производные: кислота, калиевая соль кислоты, метиловый эфир кислоты, 2,2-дихлор-5,5,6-трифтор-7-окса-бицикло-[2.2.1]гептан-6-карбоновая кислота.
Ключевые слова: Перфторакрилонитрил, фуран, [2+4]-цикло-присоединение, производные 5,5,6-трифтор-7-окса-бицикло[2.2.1]гепт-2-ен-6-карбоновой кислоты, рентгеноструктурный анализ, ЯМР-спектрометрия.
В поиске потенциальных ингибиторов шикимат-киназы (Shikimate kinase), субстратом которой является шикимовая кислота, осуществлен синтез производных 5,5,6-трифтор-7-окса-бицикло[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты для исследования их противотуберкулёзной активности. Методом ЯМР-спектрометрии было установлено, что продуктами [2+4]-циклоприсоединения перфторакрилонитрила к фурану являются два изомера 1 и 2 в соотношении 65:35. Реакция описывается следующей схемой:
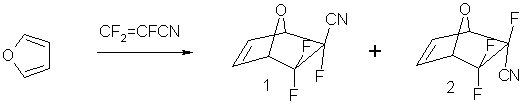
После выделения изомеров (препаративная ГЖХ) в индивидуальном состоянии методом РСА было установлено, что основной продукт 1 является экзо-изомером.
Строение молекулы 1 установлено методом рентгеноструктурного анализа. На рис. 1 показан общий вид молекулы с нумерацией атомов в ней.
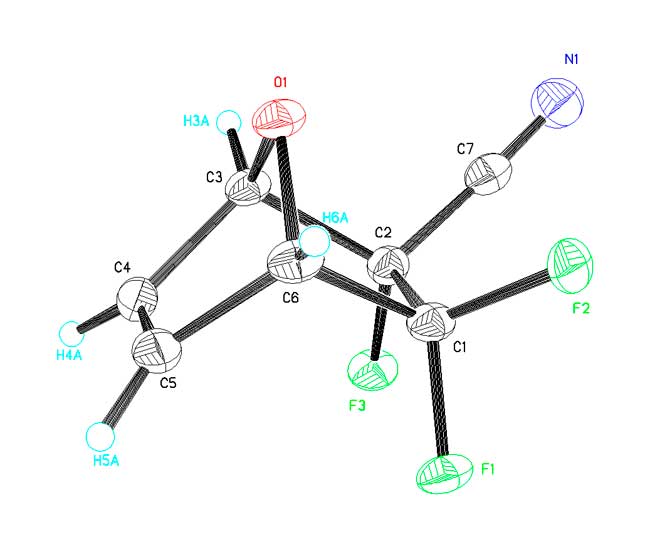
Рис. 1. Строение молекулы 1 и нумерация атомов
Длины связей и валентные углы приведены в табл. 1. Все они имеют обычные значения для бициклической системы и указывают на ее несимметричность, обусловленную, по-видимому, электронными эффектами, создаваемыми разными заместителями при атомах С(1) и С(2). Длина двойной связи С(4)-С(5) совпадает с её стандартным значением 1,33 Å [1].
Фрагмент С(3)-С(4)-С(5)-С(6) практически плоский; торсионный угол равен 0,6°. средне-квадратичные отклонения атомов от плоскости составляют 0.002, -0.003, 0.003, -0.002 Å, соответственно. Атом кислорода отклоняется от этой плоскости на 0,699 Å, что соответствует двугранному углу отгиба фрагмента С(3)-O(1)-С(6) от вышеуказанной плоскости на 132,9°.
Второй цикл бициклической системы также перегнут по линии С(3)…С(6), но в большей степени: угол между плоскостями С(6)-С(1)-С(2)-С(3) и С(3)-О(1)-С(6) равен 116,0°. Интересно то, что и в этом цикле фрагмент С(3)-С(2)-С(1)-С(6) также практически плоский с малыми выходами атомов из средней плоскости 0.003, -0.004, 0.004, -0.003 Å, соответствующими значению торсионного угла 0,1°. Больший перегиб этого цикла обусловлен, по-видимому, тем фактом, что все атомы углерода в нём имеют sp3-гибридизацию.
Нитрильный заместитель имеет обычную линейную геометрию с углом при атоме С(7), равным 176,9°.
Таблица 1. Длины связей (Å) и валентные углы (град.) в молекуле 1, в скобках приведены стандартные отклонения.
|
С(1)-С(2) |
1,574(4) |
С(6)-O(1) |
1,449(3) |
|
С(2)-С(3) |
1,575(4) |
C(1)-F(1) |
1,358(3) |
|
С(3)-С(4) |
1,519(4) |
C(1)-F(2) |
1,354(3) |
|
С(4)-С(5) |
1,330(4) |
C(2)-F(3) |
1,382(3) |
|
С(5)-С(6) |
1,508(4) |
C(2)-C(7) |
1,473(4) |
|
С(6)-С(1) |
1,543(4) |
C(7)-N(1) |
1,147(4) |
|
С(3)-O(1) |
1,437(3) |
C(3)-C(2)-C(7) |
111,1(2) |
|
C(3)-O(1)-C(6) |
97,2(2) |
F(3)-C(2)-C(7) |
108,6(2) |
|
C(6)-C(1)-C(2) |
102,0(2) |
C(2)-C(3)-O(1) |
98,2(2) |
|
C(6)-C(1)-F(1) |
114,3(2) |
C(4)-C(3)-O(1) |
103,1(2) |
|
C(6)-C(1)-F(2) |
112,1(2) |
C(1)-C(6)-C(5) |
107,0(2) |
|
C(2)-C(1)-F(1) |
110,7(2) |
C(1)-C(6)-O(1) |
98,1(2) |
|
C(2)-C(1)-F(2) |
112,1(2) |
C(5)-C(6)-O(1) |
103,0(2) |
|
F(1)-C(1)-F(2) |
106,7(2) |
C(3)-C(4)-C(5) |
105,8(3) |
|
C(1)-C(2)-C(3) |
99,9(2) |
C(4)-C(5)-C(6) |
106,2(2) |
|
C(1)-C(2)-F(3) |
110,5(2) |
C(3)-C(2)-C(7) |
111,1(2) |
|
C(1)-C(2)-C(7) |
112,8(2) |
C(2)-C(7)-N(1) |
176,9(3) |
|
C(3)-C(2)-F(3) |
113,8(2) |
Поскольку соединение отличается высокой летучестью, было интересно проанализировать его кристаллическую упаковку. Фрагмент кристаллической упаковки показан на рис. 2. В кристалле отсутствуют короткие межмолекулярные контакты, которые можно было бы интерпретировать, как слабые специфические взаимодействия, например, между атомом азота нитрильной группы и достаточно кислыми атомами водорода при атомах С(3) и С(6). Такие слабые взаимодействия, имеющие электростатическую природу, и обсуждающиеся в работах [2-5], могут в значительной степени контролировать структуру кристалла. Все межмолекулярные контакты в рассматриваемой кристаллической упаковке соответствуют Ван-дер-Ваальсовым взаимодействиям. Отсутствие специфических взаимодействий в кристалле данного соединения объясняет его высокую летучесть.
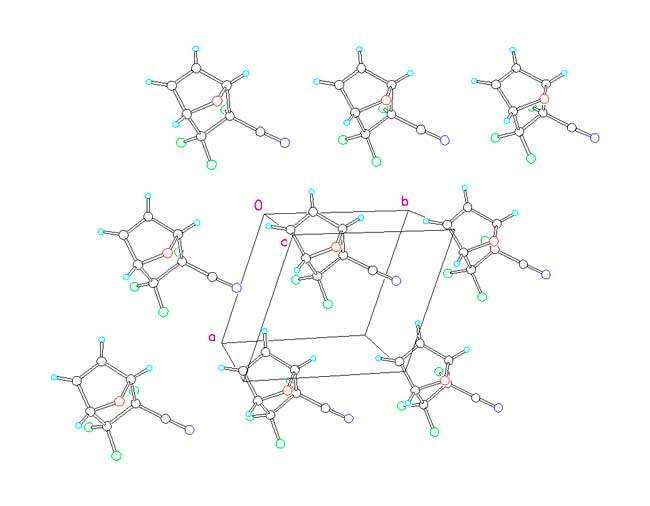
Рис. 2. Фрагмент кристаллической упаковки.
Выделение экзо-изомера в индивидуальном виде позволило осуществить на его основе синтез различных производных 5,5,5-трифтор-7-оксабицикло[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты. В условиях щелочного гидролиза из нитрила 1 с выходом 83% была получена калиевая соль 3. При обработке соли 3 соляной кислотой с последующим выделением из водного раствора с выходом 93% была получена кислота 4. В реакции калиевой соли 3 с диметилсульфатом с выходом 71% был синтезирован метиловый эфир 5,5,5-трифтор-7-оксабицикло[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты 5. При хлорировании соли 3 в среде соляной кислоты был получен с выходом 25% соответствующий продукт присоединения хлора по двойной связи бициклогептена – соответствующий бициклогептан 6. Синтез указанных соединений иллюстрируется ниже приведенной схемой:
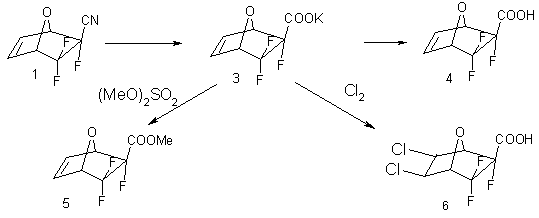
Строение соединений 1-6 доказано данными 1H и 19F-ЯМР, ИК и масс-спектроскопии.
Растворимые в воде соединения 3,4 и 6 характеризуются умеренной токсичностью; ЛД50 для белых мышей при внутримышечной аппликации составляют значения, соответственно, >1500 мг/кг, 300 мг/кг и 1600 мг/кг.
Экспериментальная часть
Рентгеноструктурный эксперимент
Экспериментальный набор интенсивностей для РСА получен на автоматическом дифрактометре Bruker SMART-CCD (Мо-излучение, графитовый монохроматор, w сканирование) в токе охлажденного азота. Вследствие летучести соединения 1, использовали монокристалл, покрытый перфторированным маслом. Кристаллографические параметры и характеристики рентгеноструктурного эксперимента приведены в табл. 2.
Редактирование экспериментальных отражений проводили с использованием программного пакета Bruker SAINT [6].
Структура расшифрована прямыми методами и уточнена методом наименьших квадратов в полноматричном анизотропном приближении по F2. Атомы водорода выявлены из разностного синтеза Фурье. Их уточнение проведено в изотропном приближении. Все расчеты проводились с использованием программного пакета SHELXTL-Plus [7].
Координаты неводородных атомов и их изотропные эквивалентные температурные параметры приведены в табл. 3.
Таблица 2. Параметры кристалла и рентгеноструктурного эксперимента
|
Соединение 1 |
Нитрил 5,5,6-трифтор-7-оксаби-цикло[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты |
|
Молекулярная формула |
C7H4NF3O |
|
Молярная масса (кг/кмоль) |
175,11 |
|
Сингония |
Триклинная |
|
Пространственная группа |
P 1 |
|
a, Å |
6,596(1) |
|
b, Å |
7,188(1) |
|
c, Å |
7,501(1) |
|
α, (°) |
91,69(3) |
|
β, (°) |
91,54(3) |
|
γ, (°) |
108,68(3) |
|
V, Å 3 |
336,5(1) |
|
Z |
2 |
|
ρ(выч.), г/см3 |
1,728 |
|
F(000) |
176 |
|
μ(MoKα), мм-1 |
0,172 |
|
Размер кристалла, мм |
0,28 × 0,32 × 0,16 |
|
Температура, ° K |
120,0(2) |
|
Излучение, Å |
Mo Kα(0,71073) |
|
Тип/область сканирования по θ, (°) |
ω / 2,72 – 26,98 |
|
Интервалы индексов отражений |
-4 ≤ h ≤ 8, -9 ≤ k ≤6, -9 ≤ l ≤ 8 |
|
Измерено отражений |
1695 |
|
Независимых отражений |
1305 [R(int) = 0.0124] |
|
Отражений с I>2σ(I) |
1305 |
|
Переменных уточнения |
126 |
|
R -факторы по I>2σ(I) |
R1 = 0,0531; wR2 = 0,1875 |
|
по всем отражениям |
R1 = 0,0622; wR2 = 0,1962 |
|
Добротность по F2 |
1,080 |
|
Остаточная электронная плотность, min/max, e/Å3 |
-0,530/0,477 |
Таблица 3. Координаты неводородных атомов (х 104) и изотропные эквивалентные температурные параметры (U2 x 103) . В скобках приведены стандартные отклонения.
|
Атом |
x |
Y |
z |
U(eq) |
|
F(1) |
3959(3) |
2167(2) |
5934(2) |
22(1) |
|
F(2) |
5312(2) |
4096(2) |
8257(2) |
22(1) |
|
F(3) |
1775(3) |
4339(2) |
5006(2) |
21(1) |
|
O(1) |
1021(3) |
3037(3) |
9475(2) |
19(1) |
|
N(1) |
3936(4) |
8124(4) |
7887(4) |
29(1) |
|
C(1) |
3444(4) |
3057(4) |
7395(3) |
17(1) |
|
C(2) |
2126(4) |
4440(4) |
6836(4) |
17(1) |
|
C(3) |
36(4) |
3510(4) |
7896(3) |
17(1) |
|
C(4) |
-1103(5) |
1508(4) |
7002(4) |
20(1) |
|
C(5) |
40(5) |
363(4) |
7469(4) |
20(1) |
|
C(6) |
1896(5) |
1638(4) |
8632(4) |
18(1) |
|
C(7) |
3194(4) |
6508(4) |
7415(4) |
20(1) |
Спектральные данные
Спектры ЯМР 1Н и 19F получены на спектрометре AVANCE-400 фирмы “Bruker” с рабочими частотами 400 (1Н) и 376,5 (19F) МГц соответственно. Съемку проводили при комнатной температуре в дейтерированных хлороформе (соединения 1-2), воде (3) и ацетонитриле (4-6). Химические сдвиги в спектрах ЯМР приведены в шкале δ относительно внутреннего стандарта: ТМС (1H) и CFCl3 (19F).
ИК-спектры записаны на спектрометре Perkin-Elmer PE-286 в растворах в тонком слое на KBr.
Масс-спектры снимали на масс-спектрометре VARIAN MAT CH-6 с устройством прямого ввода, 70 эВ.
5,5,6-Трифтор-6-циан-7-оксабицикло[2.2.1]гепт-2-ены (1 и 2). Раствор 45,0 г (0,417 моль) перфторакрилонитрила и 16,0 г (0,235 моль) фурана в 50 мл диэтилового эфира нагревали в запаянной ампуле при 95-100°С в течение 21 часа. Последующей перегонкой в вакууме получили 12,8 г (0,073 моль, 31%) смеси соединений 1 и 2 в виде бесцветной вязкой жидкости с т.кип. 95 °С при 20 мм рт.ст. Найдено,%: С 48,15; Н 2,46; N 7,93. C7H4NF3O. Вычислено,%: С 48,01; Н 2,29; N 8,00. Методом препаративной ГЖХ выделены два изомера 1 и 2. Условия разделения: хроматограф Perkin-Elmer F21; колонка – хроматон, NAV DMS 5% XE-60, длина колонки 5 м; температура испарителя, разветвлённого и соединительного трудопроводов 230 °С; температура термостата 129 °С.
5,5,6-Трифтор-6-экзо-циан-7-оксабицикло[2.2.1]-гепт-2-ен (1) имеет т.пл. 48 °С. Cпектр ЯМР 19F (50% CDCl3): 157,3 с (6-F, 1F); 107,0 м (5-F, 2F). Cпектр ЯМР 1Н (50% CDCl3):5,23 с (4-Н, 1Н);5,55 с (1-Н, 1Н); 6,68 с (2-Н, 3-Н, 2Н).
ИК-спектр (в CCl4), ν, см-1 (%, T):3029 (95), 2253 (96), 1659 (98), 1579 (96), 1311 (50), 1290 (56), 1274 (55), 1240 (85), 1211 (98), 1186 (28), 1123 (41), 1108 (24), 1057 (86), 1040 (81), 992 (35), 973 (71), 917 (56), 827 (89), 809 (100), 777 (67), 750 (21), 742 (100), 738 (90), 733 (95), 685 (84), 661 (81), 620 (95), 607 (64), 520 (97), 481 (96), 465 (95), 433 (98), 419 (97).
5,5,6-Трифтор-6-эндо-циан-7-оксабицикло[2.2.1]-гепт-2-ен (2) имеет т.пл. 42 °С. Cпектр ЯМР 19F (50% CDCl3):177,0 с (6-F, 1F); 114,8 д (5-Fэкзо, J= 225 Гц; 1F); 101,2 д (5-Fэндо, J= 225 Гц; 1F). Cпектр ЯМР 1Н (50% CDCl3):4,77 с (4-Н, 1Н); 5,10 д (1-Н, J= 6,3 Гц, 1Н); 6,50 уш.с (2-Н, 3-Н, 2Н).
ИК-спектр (в CCl4), ν, см-1 (%, T):3164 (53), 3110 (47), 3044 (53), 2959 (49), 2878 (50), 2439 (59), 2253 (55), 1973 (59), 1903 (59), 1660 (57), 1580 (48), 1461 (56), 1413 (55), 1385 (55), 1311 (29), 1038 (25), 987 (19), 971 (29), 940 (39), 919 (24), 831 (41), 793 (23), 741 (18), 686 (45), 674 (30), 608 (31), 595 (50), 531 (50), 496 (52), 412 (22).
В масс-спектрах обоих изомеров зафиксирована величина m/e (%): 175 (M+, 100).
Калиевая соль 5,5,6-трифтор-7-окса-бицикло-[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты (3). Смесь 4,5 г (25,7 ммоля) бициклогептена (1) в 10 мл диоксана и 2,9 г (51 ммоль) гидроокиси калия в 5 мл воды нагревали при перемешивании до 110-120 °С и выдерживали при этой температуре в течение 3 часов. Далее реакционную массу упаривали в вакууме, а остаток промывали диоксаном. Получили 5,0 г (83%) бесцветного кристаллического вещества (3) с т.разл. около 200 °С и хорошо растворимого в воде (не менее 30%). Найдено, %: С 36,55; Н 1,95. C7H4F3О3К. Вычислено, %: С 36,05; Н 1,72.
Cпектр ЯМР 19F (30% D2О):151,5 с (6-F, 1F); 111,0 д.д (5-Fэкзо, J= 240 Гц; J= 4,5 Гц; 1F); 107,0 д (5-Fэндо, J= 240 Гц; 1F). Cпектр ЯМР 1Н (30% D2О):5,30 с (1-Н, 1Н); 5,17 д (4-Н, J= 4,5 Гц, 1Н); 6,83 уш.с (2-Н, 3-Н, 2Н).
5,5,6-Трифтор-7-оксабицикло[2.2.1]гепт-2-ен-6-экзо-карбоновая кислота (4). К суспензии 0,90 г (3,86 ммоля) соли (3) в 20 мл хлороформа при перемешивании прибавили 7 мл концентрированной соляной кислоты, органический слой отделили, водный слой экстрагировали 5 мл хлороформа. Объединенные растворы в хлороформе упаривали, перекристаллизацией остатка из хлороформа получили 0,71 г (93%) бесцветного кристаллического вещества (4) с т.пл. 62 °С. Найдено, %: С 43,51; Н 2,89. C7H5F3О3. Вычислено, %: С 43,30; Н 2,58. Масс-спектр, m/e (%): 194 (M+, 100).
Cпектр ЯМР 19F (25% в CD3CN):158,2 с (6-F, 1F); 111,3 д.д (5-Fэкзо, J= 225 Гц; J= 4,5 Гц; 1F); 106,7 д (5-Fэндо, J= 225 Гц; 1F). Cпектр ЯМР 1Н (25% в CD3CN):5,13 с (1-Н, 1Н); 4,80 д (4-Н, J= 4,5 Гц, 1Н); 6,47 уш.с (2-Н, 3-Н, 2Н); 7,50 с (СООН, 1Н).
Метиловый эфир 5,5,6-трифтор-7-оксабицикло-[2.2.1]гепт-2-ен-6-экзо-карбоновой кислоты (5). Смесь 3,10 г (13,3 ммоль) соли (3) и 1,68 г (13,3 ммоль) диметилсульфата в 20 мл абс. диоксана перемешивали при 140-150 °С в течение 3 часов. Далее смесь фильтровали, а фильтрат перегоняли в вакууме. Получили 1,25 г (около 40%) бесцветного вещества (5) с т.пл. около 15 °С и т.кип. 70-71 °С при 1 мм рт.ст. Найдено, %: С 46,52; Н 2,99. C8H7F3О3. Вычислено, %: С 46,15; Н 3,37. Масс-спектр, m/e (%): 208 (M+, 100).
Cпектр ЯМР 19F ((40% в CDCl3):161,5 с (6-F, 1F); 112,2 д.д (5-Fэкзо, J= 227 Гц; J= 4,5 Гц; 1F); 107,5 д (5-Fэндо, J= 227 Гц; 1F). Cпектр ЯМР 1Н (25% в CD3CN):5,15 с (1-Н, 1Н); 4,77 д (4-Н, J= 4,5 Гц, 1Н); 6,51 уш.с (2-Н, 3-Н, 2Н); 3,75 с (ОСН3, 3Н).
2,3-Дихлор-5,5,6-трифтор-7-окса-бицикло[2.2.1]-гепт-2-ен-6-карбоновая кислота (6). Через раствор 1,80 г (7,73 ммоль) соли (3) в 12 мл 10%-ной соляной кислоты при интенсивном перемешивании при 75-80 °С барботировали около 5 л хлора. Затем смесь упаривали в вакууме, перекристаллизацией остатка из хлороформа получили 0,50 г (25%) бесцветного кристаллического вещества (6) с т.пл. 92 °С. Найдено, %: С 31,02; Н 2,08; Cl 26,01. C7H5Cl2F3О3. Вычислено, %: С 31,82; Н 1,89; Cl 26,59. Масс-спектр, m/e (%): 265 (M+, 100).
Cпектр ЯМР 1Н (25% в CD3CN):4,90-4,98 уш. сигнал (1-Н, 4-Н, 2-Н, 3-Н, 4Н); 6,23 с (СООН, 1Н).
Список литературы
- F. H. Allen, O. Kennard, D. G. Warson, L. Brammer, A.G. Orpen, Robin Taylor, J. Chem. Soc. Perkin Trans, II, 1987, S1-S19
- G.A. Jeffrey, W. Saenger, “Hydrogen bonding in Biological structures”, Springer, Berlin, 1991.
- J. A. R. P. Sarma, G. R. Desiraju, Acc. Chem., Res., 1986, 19, 222.
- G. R. Desiraju, J. Chem Soc. Chem. Commun., 1989, 179.
- V.R. Pedireddi, G.R Desiraju, . Chem Soc. Chem. Commun., 1992, 988.
- SAINT. Version 6.02A. Bruker AXS Inc. Madison Wisconsin, USA, 2001
- SHELXTL-Plus. Release 5.10, Bruker AXS Inc., Madison, Wisconsin, USA, 1997.
Материал рекомендован к публикации членом редколлегии А.Ф. Елеевым
Fluorine Notes, 2012, 83, 9-10
