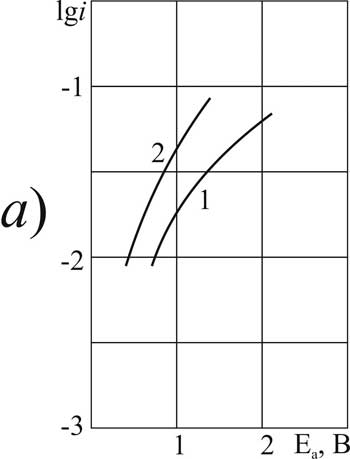Received: февраль 2012
DOI 541.135.6:541.138.2:547.221
Fluorine Notes, 2012, 83, 3-4
Анодное поведение замещённых перфторкарбоновых кислот
О.Н.Чечина*, В.В.Беренблит**, С.В.Соколов***, А.П. Томилов
*ФГБОУ ВПО Самарский Государственный Технический Университет
443100, г. Самара, ул. Молодогвардейская,
244,
e-mail: chechinao@yandex.ru
**ФГУП НИИСК им.С.В.Лебедева
198035, Санкт-Петербург, ул. Гапсальская, д. 1
***ЗАО "Анлес"
194044, Санкт-Петербург, Менделеевская, 2.
Аннотация. Выполнены вольтамперные исследования анодного процесса на платине и на стеклоуглероде в растворах α-монохлоуксусной кислоты, а также 2,3-дихлорперфторпропионовой; 3,4-дихлорперфтормасляной и дифторсульфоуксусной. Рассмотрено влияние добавки пиридина и температуры процесса. Высказаны предположения о характере влияния добавки пиридина в синтезе Кольбе для галогензамещённых перфторкарбоновых кислот, о возможности использования платинового и стеклоуглеродного анодов.
Ключевые слова: галогензамещённые перфторкарбоновые кислоты, пиридин, ацетонитрил, анодная поляризация, платиновый анод, стклоуглеродный анод, механизм синтеза Кольбе, свободные радикалы, адсорбированные радикалы.
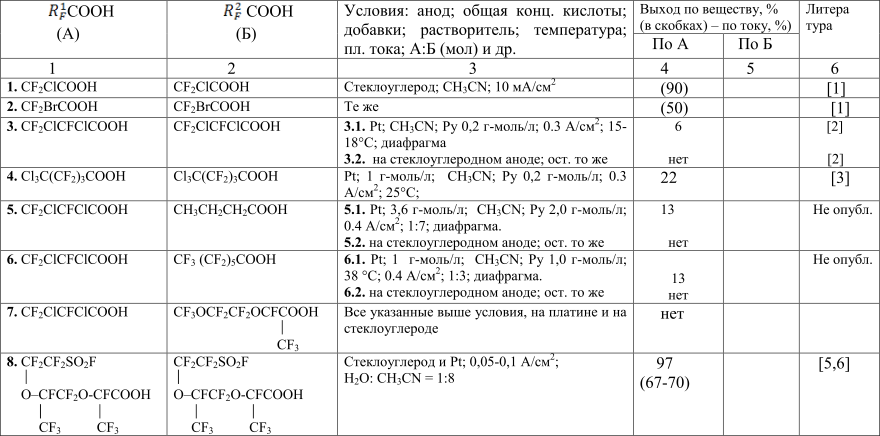
Вольтамперные исследования для галогензамещённых перфторкарбоновых кислот в условиях синтеза Кольбе представляют большой интерес. Известно, что в теории синтеза Кольбе кислоты, содержащие одиночные галогенные заместители, относятся к группе "аномальных". Но хлор и фтор, как заместители, существенно различаются: экспериментально установлено, что монохлоруксусная кислота характеризуется более высоким анодным потенциалом окисления, чем ТФУ [1]. Учитывая меньшую электроотрицательность хлора по сравнению с фтором (в составе трифторметильной группы ТФУ), можно предположить, что затруднения в данном случае имеют пространственный характер. Что касается практического аспекта, в препаративном синтезе Кольбе для перфторкарбоновых кислот с чертами аномальности экспериментально установлено положительное влияние добавки пиридина, в том числе, при осуществлении перекрёстных синтезов Кольбе в смеси кислот "нормальных" и "аномальных" ([2,3], табл. 1). Представляется, что в практике электролиза галогензамещённых перфторированных кислот может иметь значение также и достаточно высокая вероятность катодного отщепления одиночного галогенного заместителя (хлора, брома) на катоде.
В данной работе исследован характер влияния на анодный процесс в растворах перфторкарбоновых кислот таких заместителей, как хлор, бром и фторсульфоновая группа. В качестве опытных образцов использовались кислоты:
монохлоруксусная CF2ClCOOH (МХУ), см. рис.1 и 6;
2,3-дихлорперфторпропионовая CF2ClCFClCOOH (ДХП), см. рис. 2 и 7;
3,4-дихлорперфтормасляная CF2ClCFClCF2COOH (ДХМ), см. рис. 3;
α-бромперфторпропионовая CF3CFBrCOOH (БП), см. рис. 4 и 8;
фторсульфоновая кислота FSO2CF2COOH (ФС), рис 5.
Таблица 1. Оптимальные условия синтеза димеров Кольбе R1F - R2F с участием перфторированных галогензамещённых и сульфофторид-карбоновых кислот
Исследования проводились на платиновом и стеклоуглеродном (СУ) анодах с использованием ацетонитрильных растворов. Было рассмотрено влияние температуры и добавки пиридина. Поляризационные измерения проводились по методике, описанной ранее [4] как для кислот тетрафторэтилена.
Полученные результаты позволили высказать предположения о характере адсорбционных процессов в синтезе Кольбе, а также о роли катода в этой реакции.
Анодная поляризация
На примере кислоты ДХП уже установлено, что введение хлора в молекулу перфторированной кислоты не вызывает качественных изменений в характере поляризационных кривых [5].
Результаты исследования влияния добавки пиридина на вольтамперные характеристики платины и СУ при 20°C приведены на рисунках 1-5, а влияние температуры - на рисунках 5-8.
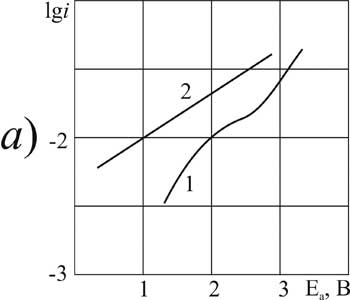
Для исследованных в данной работе α-хлорзамещённых перфторкарбоновых кислот с одним и с двумя заместителями при 20°C установлено, что введение в состав растворителя небольшого (0,09 г-моль/л) количества пиридина вызывает значительную анодную деполяризацию: на платине примерно на 2В, а на СУ-аноде – на 1 В. При этом классическая форма поляризационной кривой реакции Кольбе сохраняется до концентрации пиридина до 3,2 г-моль/л. На платиновом аноде для кислоты ДХМ эта тенденция сохраняется и при дальнейшем увеличении концентрации (рис. 3а). Для остальных кислот этой группы уже введение добавки 3,2 г-моль/л приводит к изменению природы анодного процесса и к его значительному ускорению. При этом тафелевские участки на поляризационной кривой исчезают. Для самой низшей из исследованных хлорзамещённых кислот (МХУ) на платине, а для наиболее высокомолекулярной (ДХМ) – на СУ анодные потенциалы в растворах с содержанием пиридина 3,2 г-моль/л не достигают значения 2,1 В, необходимого для протекания реакции анодной конденсации (рис. 1а, кривая 3 и рис. 3б, кривая 7).
Дальнейшее увеличение концентрации пиридина до 6,3 г-моль/л на платине для всех исследованных хлорзамещённых кислот, а для ДХМ – на СУ, обладающем наиболее гладкой поверхностью, приводит к сильному торможению процесса окисления. Оно вызывается осмолением пиридина на поверхности анода. Для растворов всех кислот данной группы на СУ форма поляризационной кривой в этих условиях меняется однотипно. Но при очень высоких концентрациях в растворах низших кислот МХУ и ДХП вместо торможения наблюдается значительная деполяризация. Эти кислоты продолжают активно участвуют в анодном окислении; потенциал анода превышает значение 2,1 В (рис. 1б и 2б, кривые 8 и 5 соответственно).
При анализе поляризационных кривых можно заметить, что соотношение плотности тока и потенциала, при которых на поляризационной кривой наблюдается характерный перегиб и становится возможным протекание синтеза Кольбе, зависит от природы анода и от природы хлорзамещённой кислоты. Так, для МХУ-кислоты "критический потенциал" при содержании пиридина 0,9 г-моль/л составляет 3,1 В на платине и 2 В на СУ-аноде. Таким образом, на платине реакция здесь протекает в более жёстких условиях. Для двух других, более высокомолекулярных кислот ДХП и ДХМ в этом же растворителе "критический потенциал" анода не зависит от материала, из которого он изготовлен.
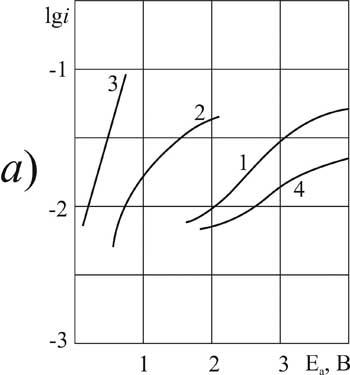
Отдельно рассмотрим электрохимические свойства бромированной кислоты БП. Для неё выбор условий синтеза более ограничен, чем для хлорзамещённых. Более устойчиво процесс идёт на СУ-аноде. На платине классическая форма кривых наблюдается только в присутствии небольших количеств пиридина – 0,1 г-моль/л (рис.4). Дальнейшее увеличение концентрации добавки вызывает торможение окисления карбоновой БП-кислоты: угол наклона "b" увеличивается, но положение кривой постепенно становится по шкале потенциалов таким же, как и в отсутствие добавки.
В отличие от галогенсодержащих фторкарбоновых кислот влияние пиридина на процесс окисления фторсульфоновой кислоты ФС не зависит от материала анода (рис. 5а и рис. 5б). Характерный вид поляризационных кривых указывает на то, что реакция может протекать лишь в отсутствие либо при небольшой добавке пиридина (0,1 г-моль/л). При более высоких концентрациях имеет место существенная деполяризация анода до потенциалов менее 2,1 В. Отравление поверхности анода здесь не наблюдается. Следовательно, смолообразование не происходит, хотя анодная димеризация по Кольбе исключается.
При анализе полученных результатов следует иметь в виду, что "нормальная" для синтеза Кольбе форма поляризационных кривых не всегда свидетельствует об успешном протекании реакции [7]. Но с учётом результатов препаративного синтеза можно заключить, что присутствие добавки пиридина является важным условием анодной димеризации для галогензамещённых фторкарбоновых кислот.
Рассмотрение влияния температуры позволяет сделать выводы о механизме влияния пиридина на протекание реакции.
В таблице 2 приводятся рассчитанные температурно-кинетическим методом значения энергии активации анодного процесса для разных кислот и разных материалов анода.
Таблица 2. Энергия активации процесса электроокисления в ацетонитрильных растворах замещённых перфторкарбоновых кислот в присутствии пиридина. Концентрации, г-моль/л: кислота – 1; пиридин – 0,09.
|
Кислота |
Анод | Энергия активации, кДж/моль |
| CF2ClCOOH | Pt СУ |
- 26,1 |
| CF2ClCFClCOOH | Pt СУ |
16,7 - |
| CF2ClCFClCF2COOH | Pt СУ |
46,0 17,7 |
| CF3CFBrCOOH | Pt СУ |
18,8 13,6 |
| FSO2CF2COOH | Pt СУ |
21,0 28,0 |
Анализ поляризационных кривых показывает, что реакции электроокисления галогензамещённых фторкарбоновых кислот в присутствии пиридина на платине протекают при более низких анодных потенциалах, чем на СУ. Но как видно из данных, представленных в таблице 2 для кислот ДХМ и БП, энергия активации реакции на платине – более высокая. Это можно объяснить только особенностями параллельно протекающих процессов, которые оказывают влияние на основную реакцию. Такими процессами в данном случае являются адсорбция и окисление пиридина на активных участках поверхности. Анодная активность пиридина вызывает возрастание энергии активации основной реакции, так как затрудняется взаимодействие с поверхностью платины инертных на аноде атомов хлора и брома в составе кислотного остатка перфторкарбоновой кислоты. Для более высокомолекулярной и хорошо адсорбирующейся кислоты ДХМ такая особенность условий реакции на платине заметна очень чётко.
Взаимодействие галогенных заместителей с поверхностью платинового анода делает условия реакции более жёстким. В то же время добавка пиридина смягчает влияние этого фактора.
Бромзамещённая кислота БП в отсутствие пиридина на платине в реакцию не вступает, соответствующие благоприятные условия могут быть созданы только в узком интервале концентраций пиридина. Однако на СУ,-аноде, который уступает платине по адсорбционной способности, такой процесс должен идти успешно в широком интервале концентраций пиридина.
Фторсульфоновая ФС-кислота по своим электрохимическим характеристикам близка к хлорзамещённым. Но существенного влияния пиридина на энергию активации процесса здесь не наблюдается: заместитель с анодной поверхностью почти не взаимодействует. Судя по результатам поляризационных измерений синтез должен в этом случае успешно протекать на любом из анодов.
Полученные результаты позволяют предположить, что на возможность и эффективность синтеза Кольбе влияют особенности микрорельефа анода. Ориентационная адсорбция и окисление молекул с димеризацией рядом расположенных радикалов происходят на плоских, гладких участках поверхности анода, занимающих по энергетическим характеристикам второе место [8]. Наиболее активные участки поверхности (выступы, углы и рёбра металлических кристаллов) хемосорбируют галогены и галогенсодержащие фрагменты молекул (кроме фтора). В этом случае остальные (плоские) участки поверхности экранируются достаточно большими фторированными фрагментами, вытесненными на границу фаз. Это является препятствием для успешного протекания процесса. Если активные участки заняты молекулами пиридина, то плоские освобождаются и на них ориентируются к аноду карбоксильные группы. На тех участках анода, которые занимают третье по энергетическим показателям место (углубления, впадины), всегда могут разряжаться небольшие по размерам молекулы растворителя (H2O, CH3OH). Это и обеспечивает прохождение тока в случае, когда адсорбированные молекулы и радикалы кислоты на поверхности присутствуют, но их энергия недостаточна, и они не могут преодолеть энергетический барьер димеризации.
Выводы
- Анодная димеризация по Кольбе с участием галогензамещённых перфторкарбоновых кислот характеризуется сложным сочетанием различных адсорбционных процессов – хемосорбции, физической адсорбции и ориентационной.
- Оптимальные условия синтеза должны способствовать ориентационной адсорбции диполей, образованных карбоксильными группами молекул фторкарбоновых кислот на гладких участках поверхности анода.
- Исходя из отмеченных особенностей, для проведения препаративной анодной конденсации с участием галогензамещённых перфторкарбоновых кислот можно рекомендовать: апротонный растворитель (стабилизирующий карбоксильные анионы), добавка пиридина к растворителю (также улучшающего диссоциацию и улучшающего условия адсорбции) и пониженная температура. Использование диафрагмы предотвратит отщепление галогенных заместителей на катоде.
- Учитывая пространственные затруднения для образования молекулярных димеров в растворе
и при переносе электронов, можно предполагать, что в данном случае (в отличие от незамещённых
перфторкарбоновых кислот) синтез Кольбе протекает предпочтительно:
–на платине – по механизму Конвея – с участием адсорбированных радикалов;
–на стеклоуглеродном аноде более вероятен процесс с участием свободных радикалов.
Литература
- Waefler J.P., Tissot P. // Electrochim. Acta. – М. 23. – P. 899-901.
- Соколов С.В., Беренблит В.В., Чечина О.Н и др. // Новости электрохим. орган. соединений 1986. ΙΧ Всесоюзн. Совещ. По электрохим. орган. соедин.: Тез. докладов. – М.: Львов, 1986. – С. 191.
- Чечина О.Н. Исследование реакции анодной конденсации по Кольбе для поли- и перфторированных кислот: Автореф. дис. канд. хим. наук – Свердловск, 1969. – 21 с.
- Чечина О.Н., Беренблит В.В., Левин А.И. Вольтамперные исследования электросинтеза Кольбе для трифторуксусной и перфторметоксиолигооксаэтиленуксусных кислот // Журн. прикл. химии, 1999. – Т. 22. Вып. 3. – С. 410-414.
- Черстков В.Ф., Гринберг В.А., Стерлин С.Р. // Изв. АН СССР. Сер. Хим. – 1990. - N 10. – С. 2448-2449.
- Заявка 3731914 ФРГ // С.А. 1989. – V. ΙΙΙ: 134912
- Ескибаева Ч.З., Чечина О.Н., Запевалов А.Я. и др. // Журн. прикл. химии. – 1990. – Т. 63, - N4 – С. 845.
- Антропов Л.И. Теоретическая электрохимия. – М.: Высшая школа, 1984. – 519 с.
Рисунки
 |
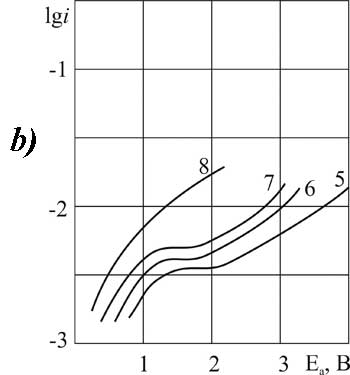 |
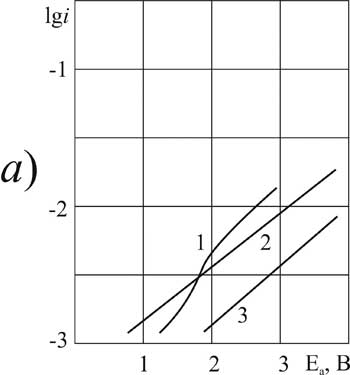
Рисунок 1. Поляризация платинового (а) и стеклоуглеродного (б) анода при 20°C в 1М растворе CF2ClCOOH> в MeCN >с добавками пиридина, М: 1,5 – 0; 2,6 – 0,09; 3,7 – 3,2; 4,8 – 6,3.
 |
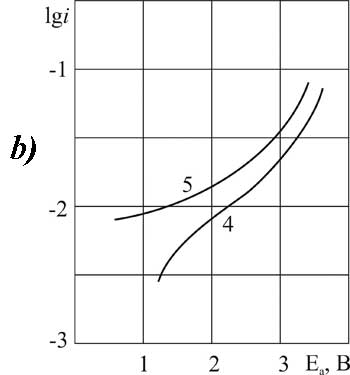 |
Рисунок 2.Поляризация платинового (а) и стеклоуглеродного (б) анода при 20°C в 1М растворе C2F3Cl2COOH> в MeCN >с добавками пиридина, М: 1 – 0; 2,4 – 3,2; 3,5 –6,3.
 |
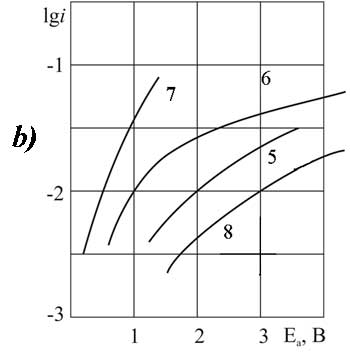 |
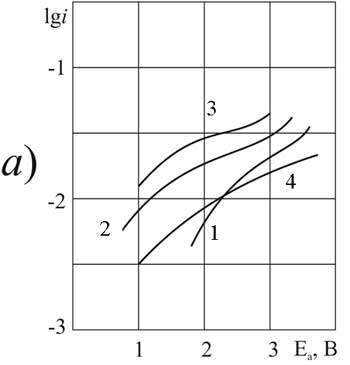
Рисунок 3.Поляризация платинового (а) и стеклоуглеродного (б) анода при 20°C в 1М растворе CF2ClCFClCF2COOH> в MeCN >с добавками пиридина, М: 1,5 – 0; 2,6 – 0,1; 3,7 –3,2; 4,8 – 6,3.
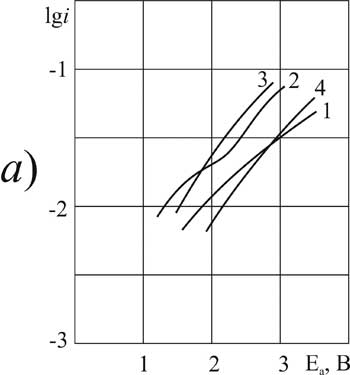 > > |
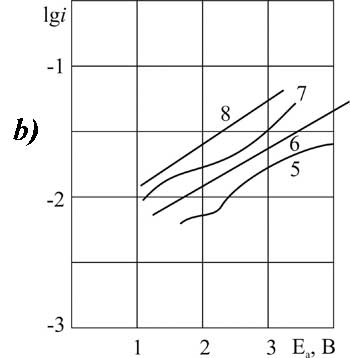 |
Рисунок 4. Поляризация платинового (а) и стеклоуглеродного (б) анода при 20°C в 1М растворе CF3CFBrCOOH> в MeCN >с добавками пиридина, М: 1,5 – 0; 2,6 – 0,1; 3,7 –3,2; 4,8 – 6,3.
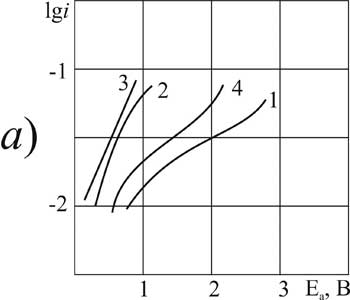 |
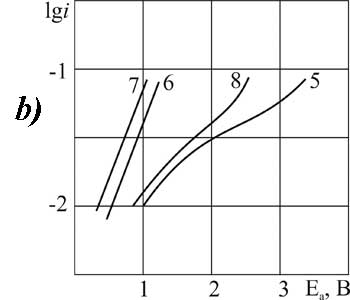 |
Рисунок 5. Поляризация платинового (а) и стеклоуглеродного (б) анода при 20°C (1-3, 5-7) и 40°C (4,8) в 1М растворе FSO2CF2COOH> в MeCN >с добавками пиридина, М: 1,4,5,8 – 0,1; 2,6 – 3,2; 3,7 – 6,3.
|
|
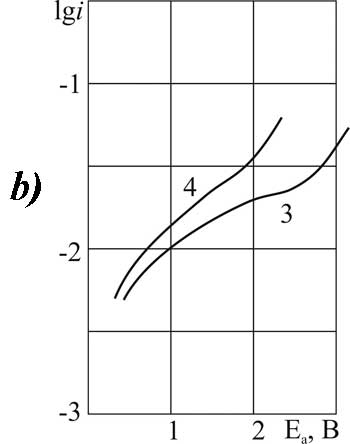 |
Рисунок 6. Поляризация платинового (а) и стеклоуглеродного (б) анода в MeCN в 1М растворе CF2ClCOOH> + 0,1 М пиридина при t>°C: 1,3 – 20; 2,4 – 40.
|
|
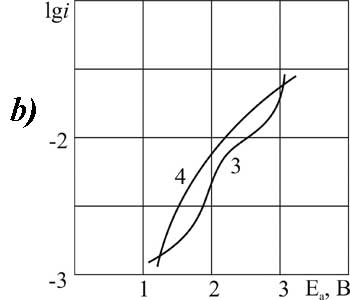 |
Рисунок 7.Поляризация платинового (а) и стеклоуглеродного (б) анода в MeCN в 1М растворе C2F3Cl2COOH + 0,1 М (3,4) или 3,2 М (1,2) пиридина при t>°C: 1,3 – 20; 2,4 – 40.
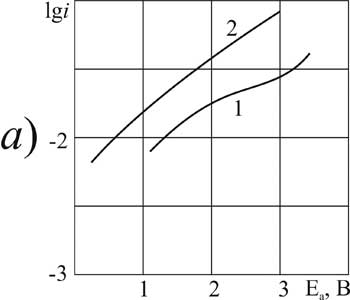 |
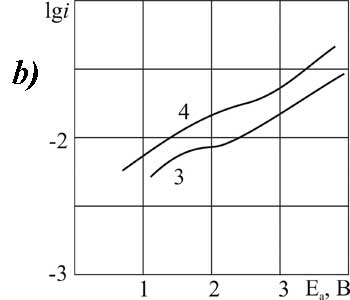 |
Рисунок 8. Поляризация платинового (а) и стеклоуглеродного (б) анода в MeCN в 1М растворе CF3CFBrCOOH> + 0,1 М пиридина при t>°C: 1,3 – 20; 2,4 – 40.
Материал рекомендован к публикации членом редколлегии А.Я. Запеваловым
Fluorine Notes, 2012, 83, 3-4