Received: май 2012
Fluorine Notes, 2012, 83, 1-2
Окисление моно- и дихлорированных бензолов и бифенилов персульфатом в присутствии C3F7• радикалов
Т.И. Горбунова, М.Г. Первова, А.Я. Запевалов, В.И. Салоутин
Институт органического синтеза им. И. Я. Постовского Уральского отделения Российской академии наук, 620990, Екатеринбург, ул. С. Ковалевской/Академическая, 22/20
e-mail: pervova@ios.uran.ru
Аннотация. Хлорароматические соединения известны как стойкие органические загрязнители. Для методов очистки почв и грунтовых вод от этих загрязнителей применяются неорганические персульфаты как реагенты окисления in situ. Эти же персульфаты используются для окислительного декарбоксилирования карбоновых кислот, их солей и сложных эфиров. В этом исследовании рассматривается реакционная способность моно- и дихлорированных бензолов и бифенилов под действием персульфата калия в присутствии калийной соли перфтормасляной кислоты. Изученный процесс не является селективным, образуются различные группы изомерных продуктов. Их структуры установлены с помощью ГХ-МС. Основными продуктами реакций являются соединения, содержащие гептафторпропильные группы. Наиболее реакционноспособными являются монохлорированные субстраты по сравнению с дихлорированными. Разработанные методики могут служить альтернативным способом химической трансформации стойких органических загрязнителей для их дальнейшей деградации.
Ключевые слова: химическое окисление in situ, моно- и дихлорированные бензолы и бифенилы, персульфат-анион, сульфат анион-радикал, свободный гептафторпропильный радикал.
1. Введение
Неорганические персульфаты являются известными окислителями, механизм действия которых изучают с целью применения для очистки загрязненных почв и грунтовых вод [1]. Действие персульфат-аниона основано на его относительно простой активации, в результате которой в предповерхностных слоях загрязненных объектов образуются активные частицы, способные разрушать загрязнители органической природы. В связи с этим неорганические персульфаты обозначают как реагенты для окисления in situ (the in situ chemical oxidation (ISCO)).
Известно несколько способов генерирования радикалов из персульфатов в водной среде с различным значением рН [2-9]. В щелочной среде персульфат-ион (S2O82-) образует in situ ион-радикальные частицы SO4•-, которые становятся движущей силой для возникновения других реакционноспособных субстратов. Эти процессы, протекающие при комнатной и повышенной температурах, суммированы в уравнениях 1-7 [7,10,11]:
S2O82- → 2SO4•- (1)
SO4•- + HO - → HSO4 - + HO• (2)
HO • + HO • → H2O + ½ O2 (3)
S2O82- + HO • → HSO4 - + SO4•- + ½ O2 (4)
S2O82- + HO • → S2O8•- + HO - (5)
SO4•- + HO • → SO42- + ½ O2 (6)
SO4•- + S2O82- → SO42- + S2O8•- (7)
Образование in situ такого числа активных частиц приводит к конкурирующим процессам, протекающим в реакционной массе. Сульфат анион-радикал (SO4•-), обладая сильными окислительными свойствами, взаимодействует с органическими молекулами по трем направлениям: может реализовываться механизм одноэлектронного переноса от SO4•- к органическому субстрату, протекать отщепление атома водорода из органической структуры, а также присоединение высокоактивных частиц к ненасыщенным фрагментам (алкеновым или ареновым) или их элиминирование.
Опубликованные результаты, в основном, относятся к исследованиям влияния окислительных свойств персульфатов на один органический объект. Работы, посвященные синергетическому действию двух и более органических соединений, находящихся в зоне реакции с персульфатом, практически отсутствуют. Однако наличие второго соединения и воздействие на него S2O82- могут привести к изменению реакционной способности всех субстратов.
Известно, что неорганические персульфаты являются инициаторами окислительного декарбоксилирования органических кислот, их солей и сложных эфиров [12-14]. Данный тип реакций характерен также для галогенсодержащих органических соединений. Так, например, в статье [15] показано, что соли алифатических перфторкарбоновых кислот в течение 50 мин декарбоксилируются в воде при 95°С под действием K2S2O8. Результатом реакции являются димерные перфторалканы:
2RFCOOK → 2RFCOO• → 2CO2 + 2RF • → RF - RF (где RF = F-Alkyl) (8)
Формально можно предположить, что возникновение радикала RFCOO• связано с переносом неспаренного электрона от образовавшейся in situ частицы SO4•- к карбоксилат-иону. Последующий выброс молекулы углекислого газа создает благоприятные условия для образования высокоактивных радикалов RF•, участвующих в рекомбинации.
Целью настоящей работы является моделирование процессов окисления хлорароматических соединений под действием неорганического персульфата в присутствии фторсодержащих реагентов. В качестве объектов окисления использованы моно- и дихлорированные бензолы и бифенилы, относящиеся к стойким органическим загрязнителям (СОЗ), а в качестве фторсодержащего реагента - калийная соль перфтормасляной кислоты (C3F7COOK). Из ряда персульфатов выбран K2S2O8, обладающий относительно низкой растворимостью в воде и более высокой температурой полураспада по сравнению с Na2S2O8 [14,15]. Полученные результаты могут служить возможным вариантом перевода токсичных хлорароматических соединений в нетоксичные (мало токсичные) или методом их предподготовки для дальнейшей деградации.
2. Материалы и методы
2.1. Химические реагенты
В работе использованы бензол, хлорбензол (99%, Alfa Aesar), о- и п-дихлорбензолы (99% и 99+% соответственно, Alfa Aesar), анилин (хч), 3- и 4-хлоранилин (хч), перфтормасляная кислота (хч), гидроксид калия (хч), персульфат калия (хч). Моно- и дихлорбифенилы синтезированы по реакции Гомберга-Бахмана-Хея по методике из статьи [16], i-амилнитрит – по методике из работы [17].
2.2. Методики эксперимента
Калийная соль перфтормасляной кислоты. Во всех случаях C3F7COOK получена in situ смешением эквимолярных количеств калийной щелочи (40%-ный раствор в дистиллированной воде) и перфтормасляной кислоты, а затем рН реакционной массы доведена до рН ≈ 10-11 добавлением калийной щелочи. В проведенных реакциях мольный избыток C3F7COOK по отношению к хлорорганическому объекту соответствует количеству незамещенных хлором атомов углерода, составляющих ароматическую структуру.
Типовая методика взаимодействия хлорароматических соединений с C3F7COOK в присутствии K2S2O8. К водному раствору 0.25 моль приготовленной in situ C3F7COOK добавили 5.6 г (0.05 моль) хлорбензола, при интенсивном перемешивании нагрели реакционную смесь до 50 °С и внесли 10.0 г (0.037 моль) K2S2O8. Продолжили нагревать реакционную смесь до 95 °С, а затем охлаждали ее до 40-50 °С и повторяли процедуру внесения 10.0 г (0.037 моль) K2S2O8. Общее количество введенного в реакцию K2S2O8 составило 40.5 г (0.015 моль). Реакционную смесь перемешивали 2 ч при 95 °С, охлаждали до 40-50 °С, затем добавляли 100 мл воды для растворения неорганических солей. При необходимости количество воды может быть увеличено. После растворения всех неорганических продуктов реакционную смесь охлаждали до tкомн. и экстрагировали CHCl3 (2 х 30мл).
2.3. Аналитические методы
Для идентификации продуктов реакций использовали газовый хроматограф-масс-спектрометр «Agilent GC 7890A MSD 5975C Inert XL EI/CI» с кварцевой капиллярной колонкой НР-5 (30 м х 26мм х 0.25мкм) с толщиной пленки неподвижной фазы 0.25 мкм (полидиметилсилоксан, 5% привитых фенильных групп) и квадрупольным масс-спектрометрическим детектором (ГХ-МС). Сканирование по полному ионному току в диапазоне масс 20-1000 а.е.м. в режиме электронной ионизации (70 эВ). Газ-носитель – гелий, деление потока 1:50. Температура колонки начальная 40 °С (изотерма 3 мин), программирование 10 °С мин-1 до 290 °С (изотерма 40 мин), температура испарителя – 250 °С, переходной камеры - 280 °С, МС-источника - 230 °С, квадруполя - 250 °С.
Количественные расчеты проводили по методу внутренней нормализации. В настоящем исследовании представлены структуры соединений, содержание которых в результирующих смесях продуктов было не ниже 0.1 %.
3. Результаты и обсуждение
3.1. Хлорбензол (ХБ).
ХБ при взаимодействии с пятикратным избытком C3F7COOK в присутствии K2S2O8 подвергся исчерпывающей конверсии с образованием многокомпонентной смеси продуктов. Сканирование каждого хроматографического пика в условиях ГХ-МС и последующая реконструкция по фрагментарным ионам масс-спектров позволили установить химические структуры соединений в результирующей смеси (схема 1), их относительное содержание представлено в таблице.
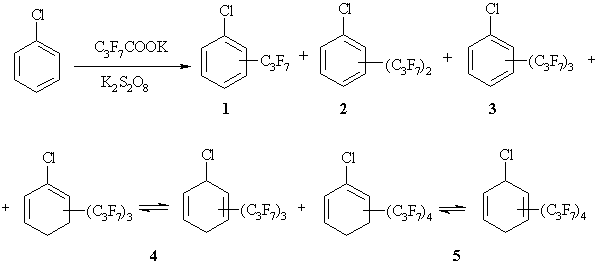
Схема 1. Смесь соединений, полученная при взаимодействии ХБ с C3F7COOK в присутствии K2S2O8.
Отметим, что взаимодействие ХБ с C3F7COOK в присутствии K2S2O8 является неселективным процессом, и в условиях реакции возможно образование групп различных изомеров. Так, например, хлор(гептафторпропил)бензол 1 в смеси продуктов представлен тремя изомерами (о-, м-, п-), которые формально получены в результате отщепления атома водорода в виде Н• под действием атаки образованного in situ радикала C3F7• по атому углерода ароматического кольца. Однако это направление реакции не является основным процессом.
Наибольший вклад в продукты взаимодействия вносят хлор[ди(гептафторпропил)]бензолы 2 (четыре изомера). Формально они являются результатом отщепления двух атомов водорода в виде Н• под действием двух C3F7• радикалов. Посредством ГХ-МС исследования, к сожалению, не удается указать точное расположение перфторалкильных заместителей в бензольном кольце. Однако известно, что преимущественными центрами радикальных атак на монозамещенные бензолы, содержащие электроноакцепторный заместитель, являются о- и п-положения [5,18]. Возможно, что наибольший вклад в суммарное содержание продуктов 2 вносит хлор-2,4-диперфторпропилбензол.
Хлор[три(гептафторпропил)]бензолы 3 составляют в смеси продуктов сравнительно небольшое количество, механизм их образования аналогичен направлениям реакции для соединений 1 и 2.
Вывод о неароматической природе соединений 4 и 5 основан на данных ГХ-МС. Молекулярные ионы продуктов 4 и 5 на две единицы больше, чем в ароматических субстратах. Имеются различия во фрагментации гептафторпропильных заместителей: в случае ароматической природы циклического фрагмента молекулы распад C3F7-группы в условиях электронной ионизации первоначально протекает как образование ионов с m/z 119 [C2F5]+, и пик иона [M-C2F5]+ является базовым в масс-спектре (для соединений 1-3). В случае структур 4 и 5 образуется ион с m/z 169 [C3F7]+, при этом пик иона [M-C3F7]+ становится базовым в масс-спектре, а пик иона [M-C2F5]+ обладает низкой интенсивностью (3-4%), что позволяет предположить циклогексадиеновую природу циклического фрагмента.
Ранее образование циклогексадиенильных частиц как промежуточных субстратов неоднократно отмечалось в радикальных реакциях ароматических соединений [2,3,5,19,20]. В отсутствие молекулярного кислорода гидроксициклогексадиенил-радикалы диспропорционируют и/или димеризуются, образуя фенолы и бифенилы соответственно [5]. В присутствии же молекулярного кислорода возможно образование пероксидного радикала С-ОО•. Однако наличие в ароматическом кольце электроноакцепторного заместителя, например, атома хлора или трифторметильной группы, делает этот процесс невозможным. Для образования С-ОО• требуется избыточная электронная плотность ароматического субстрата [5].
Ни одно из направлений стабилизации не объясняет факт образования соединений 4 и 5. Вероятно, следует обратить внимание на стерические факторы, сопровождающие взаимодействие ХБ с C3F7COOK в присутствии K2S2O8. На схеме 2 представлены пути образования ряда продуктов путем атаки C3F7• по о-, m- и n-положениям ХБ. При рассмотрении строения возникающих промежуточных субстратов важно отметить, что взаимодействие C3F7• с ХБ по m-положению ароматического цикла приводит к возможной резонансной структуре А. Для ее стабилизации необходимо отщепление атома водорода в виде Н•. Из-за специфического размещения уходящей группы между атомом хлора и сравнительно объемным перфторпропильным заместителем [21] процесс отщепления Н• становится невозможным, и образуется продукт В с циклогексадиеновой природой как результат диспропорционирования.
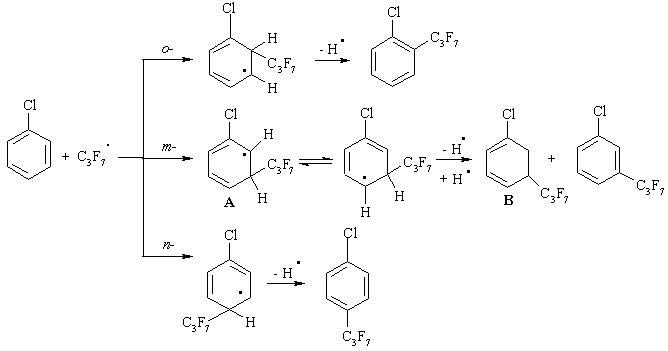
Схема 2. Возможные пути взаимодействия ХБ со свободными радикалами C3F7•.
Следуя этому предположению, из структуры В в дальнейшем могут образоваться только хлор[ди(гептафторпропил)]циклогексадиены при атаке по положениям 4 или 5. Однако этот тип соединений в результирующей смеси не обнаружен. Из всех представленных на схеме 2 структурных формул ключевыми соединениями для образования продукта 4 могут быть 1-хлор-2- и 1-хлор-3-гептафторпропилбензолы (схема 3 на примере 1-хлор-2-гептафторпропилбензола), а для образования продукта 5 – только 2-перфторпропилхлорбензол.
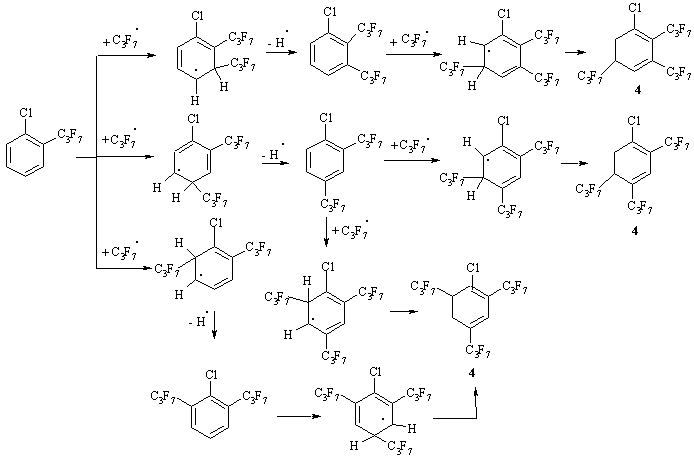
Схема 3. Возможные пути образовния циклогексадиенильных производных на основе ХБ.
Отметим также, что фрагментация производных 1,3- и 1,4- циклогексадиенов в условиях ГХ-МС (70 эВ) подобна, и поэтому необходимо учитывать процесс возможной изомеризации двойных связей в соединениях 4 и 5 из положений 1,4- в положения 1,3-. Изомеризация двойных связей характерна для аналогичных продуктов, полученных с использованием других хлорароматических субстратов.
3.2. Дихлорбензолы (о-ДХБ и п-ДХБ).
Дихлорбензолы (о- и п-) в условиях изучаемого процесса являются реакционноспособными субстратами, но исчерпывающей конверсии они не подвергаются. В продуктах реакции содержится 1.50% о-ДХБ и 7.31% п-ДХБ. Ранее посредством Density Functional Theory (DFT) расчетов установлено, что среди дихлорированных бензолов наиболее стабильным является п-ДХБ по сравнению с его о- и m-изомерами [22], что и подтверждается результатами наших исследований.
Как и в случае ХБ, результатами взаимодействия о-ДХБ и п-ДХБ с четырехкратным избытком C3F7COOK под действием K2S2O8 являются многокомпонентные смеси (схема 4, таблица), основные производные ДХБ - соединения 6 и 7 (аналогично направлениям реакции для ХБ). Для о-ДХБ обнаружено по два возможных изомера соединений 6 и 7. В случае п-ДХБ в условиях реакции возможно образование единственного продукта 6 – 1,4-дихлор-2-гептафторпропилбензола и двух изомеров соединения 7.
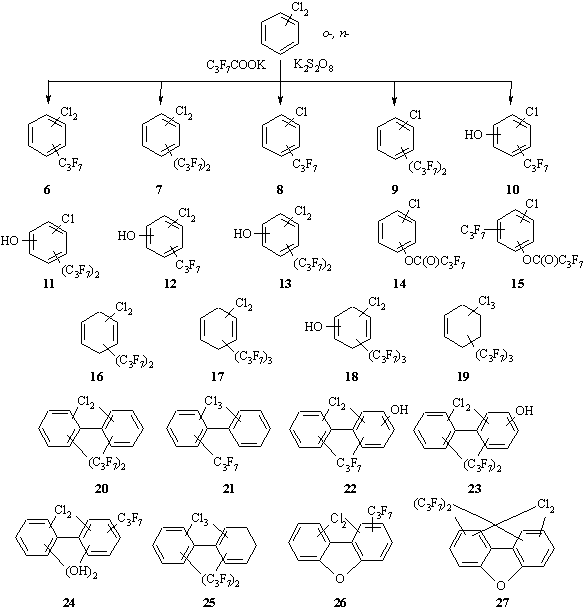
Схема 4. Смеси соединений, полученные при взаимодействиях о- и n-ДХБ с C3F7COOK в присутствии K2S2O8.
Продукты 8 (для обоих ДХБ) и 9 (только для о-ДХБ) соответствуют структурам соединений 1 и 2, образованных из ХБ. Однако предположение о гомолизе связи CAr-Cl под действием C3F7• с последующим уходом Cl• и образованием новой связи CAr – C3F7 было бы не верным. Гомолитический разрыв связи CAr-Cl в хлорбензолах является энергозатратным процессом [23], а выбранные нами реакционные условия не способствуют его реализации [24,25]. Можно предположить, что образование монохлорированных продуктов 8-11,14,15 является результатом нескольких конкурирующих процессов, протекающих в реакционной массе: присоединение и отщепление радикальных частиц, диспропорционирование, изомеризация и т.д.
Ранее было показано, что при фотолитическом инициировании частиц SO4•- из трифторметилбензола образуется гидрокситрифторметилбензол [5]. На основании констант Гаммета установлено, что предпочтительным направлением образования гидроксипроизводных является присоединение сульфат ион-радикала к ароматическому субстрату и последующая его стабилизация за счет выброса SO42- и H+ под действием воды. Однако в отсутствие фотолитического инициирования частиц SO4•- наиболее вероятным направлением образования гидроксипроизводных 11-13 является атака образованного in situ НО• (см. уравнение 2) и стабилизация ароматического цикла за счет отщепления Н•, как это было показано в исследовании [19]. Отметим, что соединение 12 образовано только из п-ДХБ.
Производные 14 и 15, представляющие собой сложные эфиры фенола и перфтормасляной кислоты, вероятнее всего, получены в результате атаки образованных in situ радикалов C3F7СОО• (см. уравнение 8) по одному из углеродных атомов ароматического цикла. Альтернативный двухстадийный путь – образование фенола под действием НО• с отщеплением водорода в виде Н• и последующая этерификация перфтормасляной кислотой – вряд ли возможен. Генерирование перфтормасляной кислоты in situ сомнительно, так как рН реакционной массы в начале процесса является сильнощелочной, а катализаторы этерификации в рассматриваемом процессе отсутствуют.
Наличие в продуктах реакции соединений 16, образованных только из о-ДХБ, не противоречит предположениям, которые сформулированы для производных ХБ. Это хорошо согласуется с фактом отсутствия соединений 16 на основе п-ДХБ. Образование продуктов 17-19 не соответствует предложенной схеме для ХБ и требует дополнительных исследований.
Известным направлением стабилизации гидроксициклогексадиенильных и арильных радикалов является их димеризация с образованием замещенных бифенилов [5,20]. Отсюда становится понятным присутствие в смесях соединений 20-25. Отметим, что все из указанных производных 20-25 формально являются результатами димеризации моно- и дихлорбензолов, но среди них нет ни одного продукта, сохраняющего количество атомов хлора начальных субстратов. Также среди соединений 20-25 нет продуктов, характерных одновременно для обоих ДХБ.
Дихлордибензофураны (ПХДФ) 26,27 обнаружены в результирующих смесях только для п-ДХБ. Возможный механизм образования ПХДФ представлен в обзоре [26]. Образование дитрифторметилдибензофурана из трифторметилбензола отмечено в работе [5].
Таким образом, с увеличением количества атомов хлора в ароматическом цикле при переходе от ХБ к ДХБ (о- и п-) число типов продуктов окисления значительно возрастает.
3.3. Монохлорбифенилы (ПХБ-Cl).
ПХБ-Cl являются компонентами некоторых коммерческих смесей полихлорбифенилов, например, Клофен А 30 [27] или Делор 103 [28]. По сути, их структура аналогична ХБ и содержит эектронодонорный заместитель (Ph). Для установления сходства и различий в реакционной способности ХБ и ПХБ-Cl реакцией арил-арильного сочетания 3-хлоранилина и бензола в присутствии изо-амилнитрита (i-Amyl-NO2) синтезирована смесь монохлорированных конгенеров ПХБ по методике работы [16] с преимущественным содержанием ПХБ 2 (3-хлорбифенила):
ClC6H4NH2 + C6H6 → C6H5-C6H4Cl (9)
Для монохлорированных бифенилов известен пример полной минерализации 2-хлорбифенила (ПХБ 1) под действием SO4•-, инициированного ионами Fe2+ из пероксимоносульфата (KHSO5), взятого в большом избытке [9]:
С12H9Cl + 28.5KHSO5 → 12CO2 + 4.5H2O + 28.5KHSO4 + Cl- (10)
Анализ смеси продуктов взаимодействия синтезированных ПХБ-Cl с девятикратным избытком C3F7COOK в присутствии K2S2O8 показывает, что данная группа конгенеров в условиях реакции подвергается исчерпывающей конверсии. Получено восемь типов производных, основными из которых являются хлор[ди(гептафторпропил)]бифенилы 29, как и в случае ХБ (схема 5, таблица). Важно отметить, что среди продуктов взаимодействия имеются нехлорированные производные 31 и 32, токсичность которых, вероятно, ниже хлорированных хлорароматических субстратов.
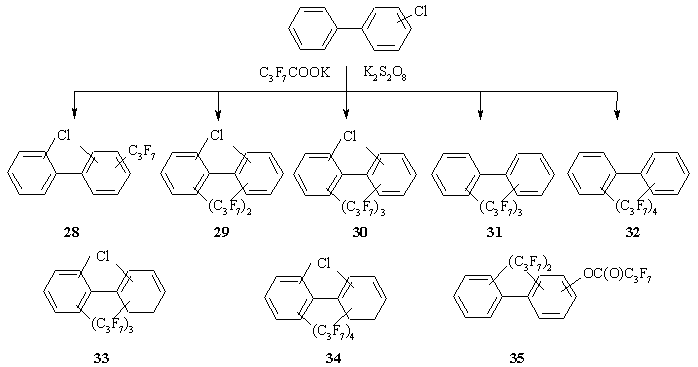
Схема 5. Смесь соединений, полученная при взаимодействии ПХБ-Cl с C3F7COOK в присутствии K2S2O8.
По итогам проведенных исследований можно констатировать, что ПХБ-Cl по своей реакционной способности аналогичны ХБ.
3.4. Дихлорбифенилы (ПХБ-Cl2).
Для установления реакционной способности дихлорированных конгенеров ПХБ синтезировано два вида производных: с расположением двух атомов хлора в одном ароматическом кольце бифенильной структуры (из анилина и 1,2-дихлорбензола):
C6H5NH2 + Cl2C6H4 → C6H5-C6H3Cl2 (11)
и с расположением двух атомов хлора по одному в каждом из ароматических циклов (из 4-хлоранилина и хлорбензола):
ClC6H4NH2 + ClC6H5 → ClC6H4-C6H4Cl (12)
Структуры продуктов на основе ПХБ-Cl2 представлены на схеме 6, их относительное содержание указано в таблице. В обеих сериях установлена неполная конверсия ПХБ-Cl2: в смеси продуктов на основе ПХБ-Cl2 из уравнения 11 обнаружено 6.40% исходных соединений, а в смеси на основе ПХБ-Cl2 из уравнения 12 – 9.27%. Наибольший вклад в продукты реакции вносят дихлор(гептафторпропил)бифенилы 36, как и в случае о- и n-ДХБ. По итогам этой серии можно констатировать, что реакционная способность ПХБ-Cl2 аналогична реакционной способности ДХБ.
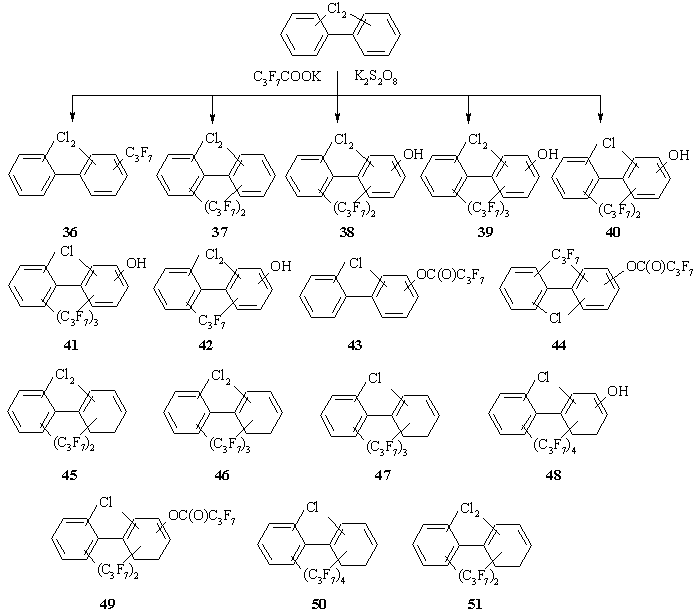
Схема 6. Смеси соединений, полученные при взаимодействиях ПХБ- Cl2 с C3F7COOK в присутствии K2S2O8.
3.5. GC-MS
В масс-спектрах всех идентифицированных соединений присутствуют пики молекулярных ионов различной относительной интенсивности (от 10 до 100 %). Также во всех масс-спектрах регистрируются пики ионов [M-F]+ и [M-HF2]+ и пики ионов, характерные для распада перфторалкильной группы [C3F7]+, [C2F5]+, [CF3]+.
В масс-спектрах производных 1-3,6-9,20,26-32,36,37,47 базовым пиком является пик иона [M-C2F5]+. Другие пики ионов имеют низкую относительную интенсивность (до 10 %). С увеличением числа С3F7-групп дальнейший распад молекулярных ионов происходит путем последовательного отрыва всех перфторалкильных групп, а затем только происходит уход атомов хлора.
В масс-спектрах производных 4,5,16-19,25,33,34,45,46,50,51 высокоинтенсивным или базовым пиком является пик иона [M-C3F7]+. Пик иона [M-C2F5]+ имеет очень низкую относительную интенсивность или может вообще отсутствовать. Пики ионов [C3F7]+, [C2F5]+, [CF3]+ обладают высокой интенсивностью, а в ряде случаев пик иона [C3F7]+ является базовым.
В масс-спектрах производных 14,15,35,43,44,49 присутствуют пики ионов [M-COC3F7]+, причем в некоторых случаях эти пики являются базовыми. В масс-спектрах производных, в структурах которых одновременно присутствуют и C3F7- и OC(O)C3F7-группы, сначала происходит отрыв С2F5-группы, а затем уже C(О)C3F7-группы.
Для производных 10-13,21-24,38-42,48 пик иона [M-C2F5]+ в масс-спектрах, в основном, является базовым. Для подобных производных, содержащих две и более C3F7-группы, характеристичным пиком является пик иона [M-119-166]+, который может отвечать отрыву групп [M-2C2F5-F-СO]+.
3.6. О практическом применении
Суммируя результаты исследования, отметим, что основной процесс, реализующийся при взаимодействии моно- и дихлорированных бензолов и бифенилов с C3F7COOK в присутствии K2S2O8, есть радикальный обмен Н• на C3F7•. Ни в одном из экспериментов не обнаружено образование перфторалкана C6F14 (см. уравнение 8). Может показаться, что такое усложнение исходных субстратов за счет введения дополнительных заместителей потенциально приведет к более сложным процессам последующей деградации смесей новых производных. Однако это упрощенный взгляд на проблемы обезвреживания СОЗ.
Во-первых, влияние атомов фтора и фторалкильных заместителей, связанных с ароматическим ядром как С-F и С-F-Alkyl соответственно, на уровни токсичности органических соединений до сих пор не ясно [29,30]. Во-вторых, разработанные нами методики позволяют получать ароматические соединения с перфторалкильными радикалами, которые обладают меньшей стабильностью по сравнению с соединениями, содержащими связь CAr–F [31]. Немаловажными являются также места расположения заместителей в ароматическом ядре и их влияние друг на друга. В-третьих, существуют примеры синергетического влияния смесей хлор- и фторсодержащих соединений на понижение их общей токсичности. Так, например, известны токсичные перфтороктановая кислота (PFOS), триклозан и 2,4,6-трихлорфенол. В индивидуальном состоянии или в бинарных смесях они препятствуют росту зеленых водорослей Pseudokirchneriella subcapitata, а их тройная смесь плохо тормозит рост водорослей [32]. В-четвертых, описан мягкий гидролиз 2-трифторметилфенола до салициловой кислоты в воде как процесс самоочищения воды под действием микроорганизмов [33], а заместитель C3F7 по своей природе аналогичен трифторметильной группе. И, наконец, последнее – известны процессы эффективной минерализации фторсодержащих карбоновых кислот под действием персульфатов в горячей воде [34] и перфтороктаноата и перфтороктансульфоната в условиях фотолиза в присутствии гуминовых кислот [35]. В обоих случаях идет процесс дефторирования в алкильной цепи начального субстрата.
Таким образом, введение перфторалкильных заместителей в ароматическое кольцо создает новые возможности для деградации хлорароматических соединений, используя более разнообразные методы как химического, так и биологического характера.
4. Выводы
По результатам проведенных исследований можно заключить следующее:
- взаимодействие моно- и дихлорированных ароматических соединений с C3F7COOK в присутствии K2S2O8 не является селективным процессом;
- основными продуктами реакций являются соединения, содержащие гептафторпропильные группы, как результаты отщепления Н• под действием образованных in situ радикалов C3F7•;
- реакционная способность моно- и дихлорированных бензолов уменьшается в ряду: ХБ > о-ДХБ > n-ДХБ;
- реакционная способность моно- и дихлорированных бифенилов уменьшается в ряду ПХБ-Cl > ПХБ-Cl2;
- реакционная способность ХБ и ПХБ-Cl практически одинакова. Они подвергаются исчерпывающей конверсии;
- среди ПХБ-Cl2 наибольшей реакционной способностью обладают структуры, содержащие два атома хлора в одном из ароматических циклов, по сравнению с ПХБ-Cl2, имеющими два атома хлора в разных ароматических циклах;
- разработанные методики могут быть использованы для снижения токсичности низкохлорированных ароматических загрязнителей или для их предподготовки с целью дальнейшего разрушения, например, микробиологическими методами.
Таблица. Продукты взаимодействия моно- и дихлорированных ароматических соединений с C3F7COOK в присутствии K2S2O8 и их содержание в выделенных смесях
|
N соединений |
Содержание в смеси, % |
Число изомеров |
Молекуляр-ный ион m/z / Iотн,% |
Характеристичные ионы m/z / Iотн,% |
|
Продукты взаимодействия на основе ХБ |
||||
|
1 |
12.7 |
3 |
280/22 |
261/4 [M-F]+, 241/1 [M-HF2]+, 211/2 [M-CF3]+, 161/100 [M-C2F5]+, 126/7 [M-C2F5-Cl]+, 69/3 [CF3]+ |
|
2 |
42.0 |
4 |
448/13 |
429/7 [M-F]+, 409/2 [M-HF2]+, 379/1 [M-CF3]+, 329/100 [M-C2F5]+, 310/1 [M-C2F5-F]+, 210/52 [M-2C2F5]+, 160/5 [M-2C2F5-CF2]+, 125/6 [M-2C2F5-CF2-Cl]+, 169/3 [C3F7]+, 119/5 [C2F5]+, 69/6 [CF3]+ |
|
3 |
1.5 |
1 |
616/4 |
597/9 [M-F]+, 547/1 [M-CF3]+, 497/100 [M-C2F5]+, 378/7 [M-2C2F5]+, 343/2 [M-2C2F5-Сl]+, 205/4 [M-2C2F5-2CF3]+, 169/2 [C3F7]+, 119/1 [C2F5]+, 69/4 [CF3]+ |
|
4 |
9.1 |
3 |
618/19 |
599/12 [M-F]+, 579/3 [M-HF2]+, 499/3 [M-C2F5]+, 449/61 [M-C3F7]+, 329/100 [M-C3F7-HC2F5]+, 210/20 [M-C3F7-HC2F5-C2F5]+, 169/79 [C3F7]+, 119/8 [C2F5]+, 69/46 [CF3]+ |
|
5 |
14.8 |
1 |
786/2 |
767/5 [M-F]+, 667/4 [M-C2F5]+, 617/3 [M-C3F7]+, 497/3 [M-C3F7-HC2F5]+, 429/23 [M-C3F7-C2F5-CF3]+, 329/17 [M-C3F7-C2F5-C3F7], 169/100 [C3F7]+, 119/3 [C2F5]+, 69/23 [CF3]+ |
|
Сумма: 80.1 |
||||
|
Продукты взаимодействия на основе о-ДХБ/n-ДХБ |
||||
|
6 |
30.5/32.2 |
2/1 |
314/35 |
295/2 [M-F]+, 275/2 [M-HF2]+, 245/1 [M-CF3]+, 195/100 [M-C2F5]+, 160/6 [M-C2F5-Cl]+, 125/12 [M-C2F5-2Cl]+, 119/2 [C2F5]+, 69/6 [CF3]+ |
|
7 |
7.2 /12.5 |
2/ 2 |
482/21 |
463/13 [M-F]+, 443/3 [M-HF2]+, 413/1 [M-CF3]+, 363/100 [M-C2F5]+, 344/12 [M-C2F5-F]+, 244/61 [M-2C2F5]+, 174/7 [M-2C2F5-2Cl]+, 169/9 [C3F7]+, 119/7 [C2F5]+, 69/11 [CF3]+ |
|
8 |
0.4/0.3 |
1/1 |
280/25 |
аналогично фрагментации соединений 1 |
|
9 |
5.8/- |
1/- |
448/15 |
аналогично фрагментации соединений 2 |
|
10 |
-/3.3 |
-/2 |
296/38 |
227/2 [M-HF2]+, 176/100 [M-C2F5]+, 147/6 [M-C2F5-HCO]+, 113/7 [M-C2F5-HCO-Cl]+, 119/2 [C2F5]+, 69/8 [CF3]+ |
|
11 |
1.1/4.5 |
1/3 |
464/22 |
445/5 [M-F]+, 425/1 [M-HF2]+, 345/100 [M-C2F5]+, 179/9 [M-2C2F5-F-CO]+, 169/1 [C3F7]+, 119/3 [C2F5]+, 69/8 [CF3]+ |
|
12 |
-/1.3 |
-/1 |
330/100 |
291/1 [M-HF2]+, 211/3 [M-C2F5]+, 160/59 [M-C3F7]+, 132/34 [M-C3F7-CO]+, 169/5 [C3F7]+, 119/8 [C2F5]+, 69/2 [CF3]+ |
|
13 |
0.2/0.7 |
1/1 |
498/52 |
429/8 [M-F]+, 379/69 [M-C2F5]+, 329/52 [M-C3F7]+, 300/4 [M-C3F7-HCO]+, 212/100 [M-2C2F5-F-HCO]+,181/29 [M-2C2F5-CF2-CO]+, 147/9 [M-2C2F5-CF2-CO-Cl]+, 169/26 [C3F7]+, 119/17 [C2F5]+, 69/6 [CF3]+ |
|
14 |
5.0/1.0 |
1/1 |
324/100 |
289/6 [M-Cl]+, 127/69 [M-COC3F7]+, 99/52 [M-COC3F7-CO]+, 73/15 [M-COC3F7-CO-C2H2-Cl]+, 169/29 [C3F7]+, 119/8 [C2F5]+, 69/38 [CF3]+ |
|
15 |
2.0/4.4 |
2/1 |
492/51 |
473/51 [M-F]+, 373/31 [M-C2F5]+, 295/17 [M-COC3F7]+, 179/100 [M- COC3F7-CO-CF3-F]+, 169/48 [C3F7]+, 119/9 [C2F5]+, 69/34 [CF3]+ |
|
16 |
6.5/- |
3/- |
484/6 |
465/4 [M-F]+, 315/100 [M-C3F7]+, 296/20 [M-C3F7-F]+, 194/31 [M-C3F7-C2F5]+, 145/45 [M-2C3F7]+, 110/12 [M-2C2F5-Cl]+, 169/23 [C3F7]+, 119/5 [C2F5]+, 69/30 [CF3]+ |
|
17 |
5.3/8.0 |
1/1 |
652/12 |
633/6 [M-F]+, 533/3 [M-C2F5]+, 483/11 [M-C3F7]+, 363/5 [M-C3F7-HC2F5]+, 314/0.2 [M-2C3F7]+, 194/25 [M-2C3F7-HC2F5]+, 169/100 [C3F7]+, 119/5 [C2F5]+, 69/26 [CF3]+ |
|
18 |
-/1.9 |
-/1 |
668/4 |
667/2 [M-F]+, 567/1 [M-C2F5]+, 517/3 [M-C3F7]+, 397/1.5 [M-C3F7-HC2F5]+, 348/3 [M-2C3F7]+, 313/3 [M-2C3F7-Cl]+, 229/14 [M-2C3F7-C2F5]+, 169/100 [C3F7]+, 119/4 [C2F5]+, 69/26 [CF3]+ |
|
19 |
2.5/- |
2/- |
688/5 |
669/2 [M-F]+, 569/0.1 [M-C2F5]+, 519/37 [M-C3F7]+, 350/3 [M-2C3F7]+, 315/10 [M-2C3F7-Cl]+, 231/2 [M-2C3F7-C2F5]+, 169/100 [C3F7]+, 119/10 [C2F5]+, 69/43[CF3]+ |
|
20 |
1.6/- |
1/- |
558/28 |
539/5 [M-F]+, 519/3 [M-HF2]+, 439/100 [M-C2F5]+, 320/22 [M-2C2F5]+, 234/12 [M-2C2F5-HCl-CF2]+, 169/3 [C3F7]+, 119/1 [C2F5]+, 69/4 [CF3]+ |
|
21 |
0.6/- |
1/- |
424/48 |
405/4 [M-F]+, 305/100 [M-C2F5]+, 269/5 [M-C2F5-Cl]+, 235/34 [M-C2F5-2Cl]+, 199/9 [M-C2F5-2Cl-HCl]+, 119/6 [C2F5]+, 69/4 [CF3]+ |
|
22 |
-/0.3 |
-/1 |
406/100 |
287/6 [M-C2F5]+, 267/94 [M-C2F5-HF]+, 232/22 [M-C2F5-HF-Cl]+, 169/14 [C3F7]+, 119/6 [C2F5]+, 69/3 [CF3]+ |
|
23 |
0.4/- |
1/- |
574/26 |
555/6 [M-F]+, 455/100 [M-C2F5]+, 419/2 [M-C2F5-HCl]+, 251/8 [M-C2F5-Cl-C3F7]+, 169/22 [C3F7]+, 119/8 [C2F5]+, 69/6 [CF3]+ |
|
24 |
-/0.4 |
-/1 |
422/100 |
284/8 [M-C2F5-H2O]+, 250/6 [M-C2F5-H2O-Cl]+, 169/34 [C3F7]+, 119/16 [C2F5]+, 69/61 [CF3]+ |
|
25 |
8.3/- |
5/- |
594/26 |
575/4 [M-F]+, 555/1 [M-HF2]+, 425/100 [M-C3F7]+, 389/28 [M-C3F7-HCl]+, 363/66 [M-C3F7-HCl-Cl]+, 234/92 [M-C3F7-2HCl-C2F5]+, 169/5 [C3F7]+, 119/12 [C2F5]+, 69/18 [CF3]+ |
|
26 |
-/0.5 |
-/1 |
404/45 |
385/3 [M-F]+, 285/100 [M-C2F5]+, 186/11 [M-C2F5-2Cl-HCO]+, 169/6 [C3F7]+, 119/1 [C2F5]+, 69/14 [CF3]+ |
|
27 |
-/0.3 |
-/1 |
572/59 |
453/100 [M-C2F5]+, 334/20 [M-2C2F5]+, 248/8 [M-2C2F5-Cl-CF2]+, 169/3 [C3F7]+, 119/1 [C2F5]+, 69/8 [CF3]+ |
|
Сумма: 77.1/71.4 |
||||
|
Продукты взаимодействия на основе ПХБ-Cl |
||||
|
28 |
2.3 |
2 |
356/29 |
337/2 [M-F]+, 237/100 [M-C2F5]+, 201/18 [M-C2F5-HCl]+, 169/1 [C3F7]+, 119/5 [C2F5]+, 69/5 [CF3]+ |
|
29 |
45.4 |
10 |
524/20 |
505/5 [M-F]+, 485/1 [M-HF2]+, 405/100 [M-C2F5]+, 369/1 [M-C2F5-HCl]+ 286/31 [M-2C2F5]+, 250/4 [M-2C2F5-HCl]+, 201/9 [M-2C2F5-HCl-CF2]+, 119/1 [C2F5]+, 69/1 [CF3]+ |
|
30 |
12.9 |
8 |
692/11 |
673/5 [M-F]+, 653/1 [M-HF2]+, 573/100 [M-C2F5]+, 454/7 [M-2C2F5]+, 419/5 [M-2C2F5-HCl]+, 300/9 [M-3C2F5-HCl]+, 169/2 [C3F7]+, 119/1 [C2F5]+, 69/3 [CF3]+ |
|
31 |
4.1 |
2 |
658/11 |
639/5 [M-F]+, 619/1 [M-HF2]+, 539/100 [M-C2F5]+, 370/1 [M-C3F7-C2F5]+, 301/5 [M-2C3F7]+, 300/9 [M-2C3F7-C2F5]+, 169/2 [C3F7]+, 119/1 [C2F5]+, 69/6 [CF3]+ |
|
32 |
1.3 |
3 |
826/13 |
807/12 [M-F]+, 787/3 [M-HF2]+, 707/100 [M-C2F5]+, 419/7 [M-3C2F5-CF3]+, 169/52 [C3F7]+, 119/8 [C2F5]+, 69/38 [CF3]+ |
|
33 |
3.7 |
2 |
694/26 |
675/15 [M-F]+, 525/100 [M-C3F7]+, 371/85 [M-C3F7-C2F5-Cl]+, 201/20 [M-2C3F7-C2F5-HCl]+, 169/26 [C3F7]+, 119/8 [C2F5]+, 69/44 [CF3]+ |
|
34 |
9.3 |
4 |
862/20 |
743/11 [M-C2F5]+, 693/72 [M-C3F7]+, 573/25 [M-C2F5-C3F7]+, 405/100 [M-C2F5-2C3F7]+, 385/56 [M-C2F5-2C3F7-HF]+, 351/11 [M-C2F5-2C3F7-F-Cl]+, 169/82 [C3F7]+, 119/19 [C2F5]+, 69/86 [CF3]+ |
|
35 |
1.4 |
2 |
702/18 |
683/6 [M-F]+, 663/2 [M-HF2]+, 583/100 [M-C2F5]+, 386/1 [M-C2F5-COC3F7]+, 169/17 [C3F7]+, 119/3 [C2F5]+, 69/14 [CF3]+ |
|
Сумма: 80.4 |
||||
|
Продукты взаимодействия на основе ПХБ-Cl2 с двумя атомами хлора в одном ароматическом кольце/с двумя атомами хлора в двух ароматических кольцах |
||||
|
36 |
20.4/12.3 |
5/7 |
390/57 |
371/3 [M-F]+, 351/2 [M-HF2]+, 271/100 [M-C2F5]+, 235/5 [M-C2F5-HCl]+ 201/20 [M-C2F5-2Cl]+, 150/5 [M-2C2F5-HCl-CF2]+, 119/1 [C2F5]+, 69/3 [CF3]+ |
|
37 |
1.7/10.9 |
3/8 |
558/25 |
аналогично фрагментации соединения 20 |
|
38 |
6.0/- |
7/- |
574/18 |
аналогично фрагментации соединения 23 |
|
39 |
4.6/- |
6/- |
742/25 |
723/3 [M-F]+, 703/2 [M-HF2]+, 623/100 [M-C2F5]+, 457/5 [M-C2F5-F-CO]+, 169/12 [C3F7]+, 119/6 [C2F5]+, 69/40 [CF3]+ |
|
40 |
5.6/- |
4/- |
540/100 |
501/11 [M-HF2]+, 401/79 [M-C2F5-HF]+, 219/45 [M-C2F5-HF-Cl-CO]+, 169/9 [C3F7]+, 119/7 [C2F5]+, 69/15 [CF3]+ |
|
41 |
6.1/- |
7/- |
708/11 |
689/4 [M-F]+, 589/30 [M-C2F5]+, 372/100 [M-2C2F5-CF2-HCO-F]+ 301/12 [M-3C2F5-CF2]+, 169/13 [C3F7]+, 119/5 [C2F5]+, 69/26 [CF3]+ |
|
42 |
2.3/- |
4/- |
406/100 |
аналогично фрагментации соединения 22 |
|
43 |
18.5/7.3 |
4/4 |
400/93 |
203/100 [M-COC3F7]+, 175/37 [M-COC3F7-CO]+, 139/37 [M-COC3F7-CO-Cl]+, 115/6 [M-COC3F7-CO-Cl-C2H2]+, 169/13 [C3F7]+, 119/2 [C2F5]+, 69/30 [CF3]+ |
|
44 |
10.8/15.6 |
5/10 |
568/32 |
549/3 [M-F]+, 449/100 [M-C2F5]+, 371/5 [M-COC3F7]+, 343/2 [M-COC3F7-CO]+, 252/1 [M-C2F5-COC3F7]+, 224/26 [M-C2F5-COC3F7-CO]+, 201/9 [M-C2F5-COC3F7-CO-Cl]+, 169/10 [C3F7]+, 119/2 [C2F5]+, 69/10 [CF3]+ |
|
45 |
1.5/- |
1/- |
560/38 |
541/7 [M-F]+, 441/4 [M-C2F5]+, 391/100 [M-C3F7]+, 355/36 [M-C3F7-HCl]+, 320/6 [M-C3F7-2HCl]+, 222/78 [M-2C3F7]+, 152/35 [M-2C3F7-2HCl]+, 169/6 [C3F7]+, 119/5 [C2F5]+, 69/27 [CF3]+ |
|
46 |
0.6/2.6 |
1/2 |
728/38 |
709/6 [M-F]+, 689/2 [M-HF2]+, 559/100 [M-C3F7]+, 390/50 [M-2C3F7]+, 335/20 [M-2C3F7-C2F5-HCl]+, 169/24 [C3F7]+, 119/12 [C2F5]+, 69/38 [CF3]+ |
|
47 |
-/1.5 |
-/1 |
692/11 |
аналогично фрагментации соединений 30 |
|
48 |
-/3.5 |
-/2 |
876/7 |
857/1 [M-F]+, 757/48 [M-C2F5]+, 617/100 [M-2C2F5-HF]+, 469/18 [M-3C2F5-HF-HCO]+, 169/61 [C3F7]+, 119/21 [C2F5]+, 69/76 [CF3]+ |
|
49 |
-/0.9 |
-/2 |
736/45 |
717/9 [M-F]+, 567/12 [M-C3F7]+, 539/100 [M-COC3F7]+, 251/32 [M- COC3F7-2C2F5-CF2]+, 169/60 [C3F7]+, 119/15 [C2F5]+, 69/70 [CF3]+ |
|
50 |
-/0.9 |
-/1 |
862/20 |
аналогично фрагментации соединений 34 |
|
51 |
-/10.1 |
-/8 |
896/54 |
877/17 [M-F]+, 857/3 [M-HF2]+, 777/8 [M-C2F5]+, 707/100 [M-C3F7-HF]+ 553/34 [M-C3F7-HF-C2F5-HCl]+, 169/55 [C3F7]+, 119/11 [C2F5]+, 69/86 [CF3]+ |
|
Сумма: 78.3/65.6 |
||||
Работа выполнена при финансовой поддержке Уральского отделения РАН (проект N 12-М-34-2036).
Список литературы
- Watts R.J., Teel A.L. // Pract. Period. Hazard. Toxic Radioact. Waste Manage. 2006. Vol. 10. P. 2–9.
- Neta P., Madhavan V., Zemel H., Fessenden R.W. // Amer. Chem. Soc. 1977. Vol. 99. P. 163-164.
- Eberhardt M.K., Fuentes-Aponte A. // J. Org. Chem. 1983. Vol. 48. P. 3444-3448.
- Minisci F., Citterio A. // Acc. Chem. Res. 1983. Vol. 16. P. 27-32.
- Rosso J.A., Allegretti P.E., Mártire D.O., Gonzalez M.C. // J. Chem. Org., Perkin Trans.1999. N 2. P. 205-210.
- Liang C., Bruell C.J., Marley M.C., Sperry K.L. // Chemosphere. 2004. Vol. 55. P. 1225-1233.
- Liang C., Wang Z.-S., Bruell C.J. // Chemosphere. 2007. Vol. 66. P. 106-113.
- Anipsitakis G.P., Dionysiou D.D., Gonzalez M.A. // Еnv. Sci Tech. 2006. Vol. 40. P. 1000-1007.
- Rastogi A., Al-Abed S.R., A Dionysiou D.D. // Applied Cat. B: Env. 2009. Vol. 85. P. 171-179.
- Dogliotti L., Hayon E. // J. Phys. Chem. 1967. Vol. 71. P. 2511-2516.
- Gonzalez M.C., Martire D.O. // Water Sci. Tech. 1997. Vol. 35. N 4. P. 49-55.
- Madhavan V., Levanon H., Neta P. // Radiat. Res. 1978. Vol. 76. N 1. P. 15-22.
- Serguchev U.A., Beletskaya I.P. // Russ. Chem. Rev. 1980. Vol. 69. P. 2257-2285.
- Tanner D.D., Osman S.A.A. // J. Org. Chem. 1987. Vol. 52. P. 4689-4693.
- Сергучев Ю.А., Давыдова И.Г. // ЖОрХ. 1982. Т. 18. Вып. 12. С. 2610-2611.
- Mullin M.D., Pochini C.M., McCrindle S., Romkes M., Safe S.H., Safe L.M. // Environ. Sci. Technol. 1984. Vol. 18. N. 6. P. 468-476.
- Becker, H., Berger, W., Domschke, G., Fanghänel, E., Faust, J., Fischer, M., Gents, F., Gewald, K., Gluch, R., Mayer, R., Müller, K., Pavel, D., Schmidt, H., Schollberg, K., Schwetlick, K., Seiler, E., Zeppenfeld, G. Organikum. Organisch-chemisches Grundpraktikum, sixth ed. VEB Deuutcher Verlag der Wissenschaften, Berlin, 1967. S. 516.
- Metelitsa D.I. // Russ. Chem. Rev. 1971. Vol. 40. P. 563 – 579.
- Eberhardt M.K. // J. Amer. Chem. Soc. 1981. Vol. 103. P. 3876-3878.
- Rosso J.A., Bertolotti S.G., Braun A.M., Mártire D.O., Gonzalez M.C. // J. Phys. Org. Chem. 2001. Vol. 14. P. 300-309.
- Timperley C.M., White W.E. // J. Fluor. Chem. 2003. Vol. 123. P. 65-70.
- Taskinen E. // Structural Chem. 2000. Vol. 11. N 5. P. 293-301.
- Cioslowski J., Liu G., Moncrieff D. // J. Phys. Chem. A. 1997. Vol. 101. N 5. P. 957-960.
- Alegre M.L., Geronés M., Rosso J.A., Bertolotti S.G., Braun A.M., Mártire D.O., Gonzalez M.C. // J. Phys. Chem. A. 2000. Vol. 104. P. 3117-3125.
- Mártire D.O., Rosso J.A., Bertolotti S.G., Le Roux G.C., Braun A.M., Gonzalez M.C. // J. Phys. Chem. A. 2001. Vol. 105. P. 5385-5392.
- Gorbunova T.I., Saloutin V.I., Chupakhin O.N. // Russian Chemical Reviews. 2010. Vol. 79. N 6. P. 511-530.
- Ballschmiter K., Zell M. // Fresenius` J. Anal. Chem. 1980. Vol. 302. N 1. P. 20-31.
- Hetflejš J., Czakóvá M., Řeřicha R., Včelák J. // Chemosphere. 2001. Vol. 44. P. 1521-1529.
- Yang H., Yu H.-X., Han Q.-G., Wang L.-S., Zhang Z. // Chemosphere. 1997. Vol. 35. P. 2657-2663.
- Hagenaars A., Vergauwen L., De Coen W., Knapen D. // Chemosphere. 2001. Vol. 82. P. 764-772.
- Shi J., Liu H., Sun L., Hou H., Xu Y., Wang Z. // Chemosphere. 2011. Vol. 84. P. 296-304.
- Boltes K., Rosal R., Garćia-Calvo E. // Chemosphere. 2012. Vol. 86. P. 24-29.
- Reinscheid U.M., Vervoort L., Zuilhof H. // Chemosphere. 2006. Vol. 65. P. 318-323.
- Hori H., Murayama M., Inoue N., Ishida K., Kutsuna S. // Catal. Today. 2010. Vol. 151. P. 131-136.
- Park H. // Rev. Roum. Chim. 2010. Vol. 55. N 1. P. 611-619.
Материал рекомендован к публикации членом редколлегии А.Я. Запеваловым
Fluorine Notes, 2012, 83, 1-2
