Received: декабрь 2011
Fluorine Notes, 2012, 82, 9-10
Особенности термолиза ди(полифторалкил) пероксидикарбонатов и их применение
А.И.Рахимов, Л.А.Бутковская
*Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация. Рассмотрены особенности термолиза и генерирования полифторалкоксирадикалов из ди(полифторалкил)пероксидикарбонатов, [X(CF2)nCH2OC(O)O]2, где X=H, F; n=1, 2, 4, 6 , предложенных в качестве инициаторов полимеризации винилхлорида. Полученный поливинилхлорид имеет большую термостабильность. Это приводит к снижению потребляемого соевого масла для получения пленки.
Ключевые слова: Ди(полифторалкил)пероксидикарбонаты, полифтор алкокси радикалы, поливинилхлорид.
Ранее показано,что ди(полифторалкил)пероксидикарбонаты позволяют получить суспензионный поливинилхлорид с повышенной термо- и светостойкостью[ 1].
Нами рассмотрена кинетика термического разложения ди (полифторалкил)пероксидикарбонатов, X(CF2)nCH2OC(O)O]2 ,где X=Н, n=2 (I), n=4 (II) в бензоле и этилбензоле при начальной концентрации пероксида 4·10-2 моль/л.Это позволяет минимизировать процессы индуцированного распада с участием свободных радикалов, образующихся из пероксида.
В табл. 1 представлены константы скорости термолиза, периоды полураспада, τ1/2 и энергии активации указанных пероксидов в сравнении с широко применяемым ди(н-бутоксиэтил)пероксидикарбонатом (III). Введение перфторированной углеродной цепочки в ди(алкил)пероксидикарбонат (I) и её удлинение (II) более, чем в два раза, уменьшает константу скорости термолиза в бензоле по сравнению с незамещенным пероксидом III: kтерм. при 70°С для I, II и III равны соответственно 3.30, 3.10 и 7.36 с-1. Период полураспада, τ1/2 пероксидов при 70°С изменяется в следующей последовательности: I – 35 мин, II – 38 мин, III – 16 мин.
Таблица 1. Кинетические параметры термолиза ди(полифторалкил)перокидикарбонатов (концентрация 4·10-2 моль/л) в сравнении с ди (н-бутил)пероксидикарбонатом (VII) (концентрация 1·10-2 моль/л)
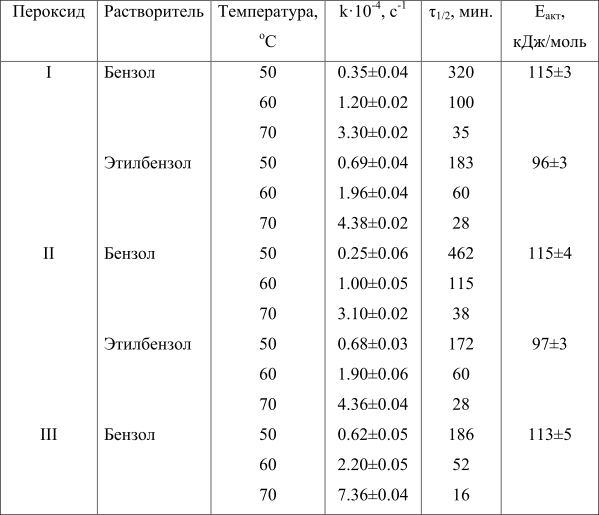
Период полураспада, константы скорости мономолекулярного распада и энергии активации при переходе от бензола к этилбензолу значительно отличаются (табл. 1): энергия активации термолиза снижается со 115 до 96–97 кДж/моль. Наиболее значительно отличаются константы скорости термолиза пероксидов при 50°С: I 0.35 с-1 (бензол) и 0.69 с-1 (этилбензол); II 0.25 с-1 (бензол) и 0.68 с-1 (этилбензол). Увеличение константы скорости термолиза пероксидикарбонатов при переходе от бензола к этилбензолу (при 50°С) для пероксида I почти в 2 раза и для пероксида II в 2.7 раза объясняется отрывом полифторалкоксильными радикалами атома водорода от этилбензола. Фенилэтильные радикалы, образующиеся при этом, атакуют пероксидную группу пероксидикарбоната:
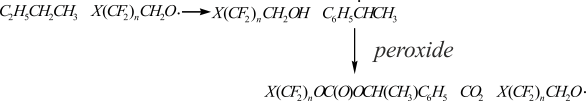
На образование полифторалкоксильных радикалов указывает высокое содержание в продуктах термолиза пероксида I в этилбензоле при 70°С 1,1,3-тригидроперфторпропанола (1.27 моль на 1 моль пероксида), диоксида углерода (1.58 моль на 1моль пероксида) и карбонатов (0.28 моль на 1 моль пероксида).
Карбонатные радикалы, образующиеся при мономолекулярном распаде пероксидикарбоната I по О–О-связи распадаются на тетрафторпропокси радикалы и СО2 (определено 1.58 моль СО2 на 1 моль разложившегося пероксида).
Основная часть тетрафторпропокси радикалов (1.27 моль на 1 моль разложившегося пероксида) реагирует с этилбензолом, что приводит к получению (1.27 моль на 1 моль распавшегося пероксида) 1,1,3-тригидроперфторпропанола. Небольшая часть этих радикалов (0.31 моль на 1 моль распавшегося пероксида) подвергается β-распаду, что согласуется с количеством обнаруженного формальдегида.
Электрофильные свойства полифторалкоксирадикалов, генерируемых из полифторалкилпероксидикарбоната при полимеризации винилхлорида, облегчают атаку Н2С-группы винилхлорида по сравнению с незамещенными алкоксирадикалами, генерируемыми из ди(алкил)дипероксикарбонатов. Это приводит к уменьшению дефектов в макромолекулярной цепи поливинилхлорида [2] с одновременной c его наномодификацией:
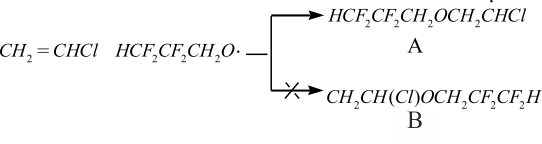
Радикал А более стабилен, по сравнению с радикалом Б на 0.310 eV, чем объясняется предпочтительность его образования. Благодаря указанным обстоятельствам суспензионный поливинилхлорид, полученный с использованием ди(полифторалкил)пероксидикарбонатов имеет более упорядоченную структуру, содержит меньшее количество лабильных групп и поэтому значительно более термостабилен, чем при применении ди (н-бутоксиэтил)пероксидикарбоната [2].
Данные о параметрах процесса полимеризации винилхлорида в присутствии в какчестве инициаторов ди(полифторалкил)пероксидикарбонатов и свойства полученных образцов поливинилхлорида представлены в табл. 2. В этой же таблице приведены сопоставительные данные, характеризующие полимер, полученный в присутствии используемого в промышленности незамещенного пероксидикарбоната – ди(н-бутоксиэтил)пероксидикарбоната.
Поливинилхлорид, полученный с фторсодержащим инициатором, характеризуется в 3,0 – 3,5 раза большей собственной термической стабильностью, чем ПВХ, полученный с использованием в качестве инициатора незамещенного пероксидикарбоната в аналогичных условиях, что можно объяснить внедрением фторированных фрагментов инициатора в полимерную цепь. Повышение термической стабильности ПВХ проявляется и в снижении скорости его дегидрохлорирования (табл. 2) [3].
Таблица 2. Параметры процесса суспензионной полимеризации вуинилхлорида в присутствии ди(полифторалкил)пероксидикарбонатов в сравнении с ди(н-бутил)пероксидикарбонатом (III) и свойства полимера
|
Инициатор |
t °c |
Время, |
Конверсия, % |
Кф |
Ннеобратимое поглощение |
Насыпная |
Скорость дегидрохлорирования V·107 |
Время начала |
|
I |
53 |
6 |
82 |
71 |
21 |
0,50 |
4,3 |
30 |
|
II |
53 |
5 |
81 |
71 |
25 |
0,49 |
4,1 |
35 |
|
III |
53 |
7 |
82 |
72 |
20 |
0,50 |
5,5 |
10 |
Необходимо отметить также, что получаемые в присутствии новых инициаторов образцы поливинилхлорида характеризуются равномерным распределением частиц по размеру. Полимерные частицы однородны по составу, имеют сферическую форму и высокоразвитую поверхность, пористая структура частиц обусловливает более высокую ( на 5 – 25 %) скорость и повышенную массу поглощения пластификатора.
Повышенная термостабильность получаемого ПВХ наглядно проявляется и при приготовлении полимерных композиций.
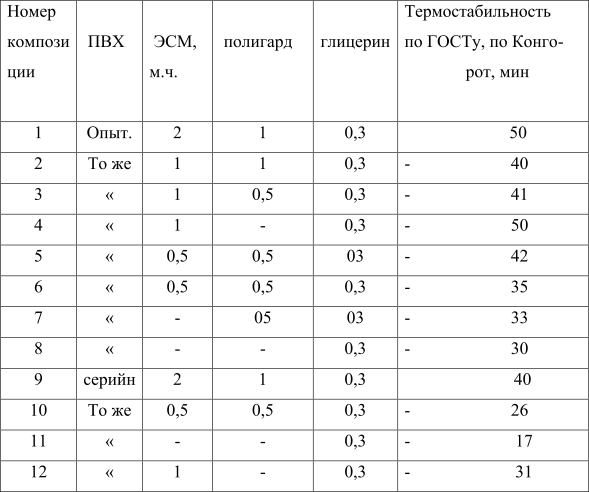
Представленные в таблице 3 свойства ПВХ – композиций, получаемых при переработке такого полимера, подтверждают эти выводы.
Как видно из табл. 3, использование полимера, полученного в присутствии ди(полифторалкил)пероксидикарбонатов, позволяет сократить расход эпоксидированного соевого масла (ЭСМ) в 2 – 4 раза и исключить необходимость использования полигарда (композиция 4 и 5), тем не менее термостабильность образующейся при этом плёнки превосходит или сохраняется на уровне плёнки, полученной из серийного полимера по стандартной рецептуре (композиция 9). Образцы пленок приготовлялись вальцеванием ПВХ –композиций в течение 10 минут при 170 °С и зазоре между валками 0,6 мм.
Таблица 3. Свойства композиций на основе поливинилхлорида С-7058 М
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кинетика термического разложения ди(полифторалкил)перокси дикарбонатов изучалась ампульным методом в бензоле и этилбензоле в атмосфере очищенного азота при температурах 50, 60 и 70°С в ультратермостате. Через определенные промежутки времени ампулы (объем 1 мл) извлекали (2 параллельных пробы), охлаждали и после вскрытия определяли количнство нераспавшегося пероксида методом иодометрического титрования [1].
Изучение состава продуктов термолиза пероксидикарбонатов в растворе этилбензола проводили после выдержки образцов при 70оС в течение не менее 10 периодов полураспада в ампулах по 15 мл каждая. Газообразные продукты анализировали на хроматогрфе «Цвет – 104», колонка из нержавеющей стали 300×0.4 см, сорбент – активированный уголь АГ – 3. Температура колонки 227°С, детектора – 250°С, испарителя – 300°С. Газ-носитель – гелий, давление 25 кгс/см2. Качественный состав газов определяли сравнением времен удерживания чистых образцов и компонентов реакционной смеси, количество определяли методом простой нормировки.
Жидкие продукты реакционной смеси идентифицировали и количественно определяли на хроматографе «Цвет – 134», колонка 300×0.4 см, адсорбент – SE-30 (5%) на хроматоне N-AW. Температура колонки 60°С, детектора – 110°С, испарителя – 270°С. Газ-носитель – гелий – подавали со скоростью 20 см3/мин, скорость движения диаграммы 600 мм/ч. Идентификацию жидких продуктов проводили методом «свидетелей» путем сравнения времен удерживания чистых образцов, их эталонов в этилбензоле и компонентов реакционной смеси. Количественные измерения проводили методом внутреннего стандарта [4].
Суспензионную полимеризацию винилхлорида проводили в стальном автоклаве ёмкостью 4.0 л, снабженной мешалкой (350 об/мин) и автоматически регулируемой системой охлаждения – обогрева, загружают 2000 мл обессоленной воды, 2.0 г гидроксида натрия, 1.2 г метилцеллюлозы марки F – 65. Содержимое автоклава вакуумируют, после чего загружают 1000 г винилхлорида, содержащего инициатор в количестве 0.01 – 0.1 % от максы мономера. Температура полимеризации 53-54 °С. Окончание процесса при падении давления на 2 атм. Параметры процесса полимеризации винилхлорида определяли, используя известные соотношения [5], свойства полученного полимера приведены в табл. 2.
Термостабильность поливинилхлорида определяли по скорости элиминирования хлористого водорода из ПВХ при термодеструкции в вакууме. Метод основан на количественном определении выделяющегося хлористого водорода меркуриметрическим титрованием.
Таким образом, применение ди(полифторалкил)пероксидикарбонатов при полмеризации винил хлорида позволяет значительно ( в 3,5 раза) повысить термостабильность получаемого поливинилхлорида и упростить технологию егопереработки.
СПИСОК ЛИТЕРАТУРЫ
[1].Рахимов А.И., Бутковская Л.А., Бакланов А.В // Изв. ВолгГТУ. Сер. «Химия и технология элементорганических мономеров и полимерных материалов». Межвуз. сб. науч. ст. / ВолгГТУ. Волгоград. 2008. Вып. 39. №1. С. 85.>
[2]. Rakhimov A.I. Initiators for Manufacture of PVC. New York: Nova Science Publishers Inc., 2008. 182 p.
[3]. Рахимов А.И. Химия и технология органических перекисных соединений. М.: Химия, 1979. 339 с.
[4]. Рахимов А.И., Бутковская Л.А., Бакланов А.В., Зегельман В.И. Способ получения суспензионного поливинилхлорида. А.с.№ 1431302,1987г.
[5]. Антоновский В.Л., Бузланова М.М. Аналитическая химия органических пероксидных соединений. М.: Химия, 1978. 308 с.
[6]. Оудиан Дж. Основы химии полимеров. – М.: Мир. 1974. 614 с.
Материал рекомендован к публикации членом редколлегии проф. А.И. Рахимовым
Fluorine Notes, 2012, 82, 9-10
