Received: март 2012
Fluorine Notes, 2012, 82, 11-12
Синтез полифторсодержащих эфиров адамантана
Г.М. Бутов*, С.В. Дьяконов*, В.М.Мохов**
*Волжский политехнический институт (филиал) ВолгГТУ 404121, Волго-градская обл., г. Волжский, ул. Энгельса,
д. 42а,
e-mail: butov@volpi.ru
**Волгоградский государственный технический университет 400131, Волгоград, пр. Ленина, 28
Аннотация. Взаимодействием 1,3-дегидроадамантана с полифторированными спиртами H(CF2)nCH2OH, где n=2,4, получены полифторсодержащие эфиры адамантана с выходом 68-77%.
Ключевые слова: Полифторированный спирт, 1,3-дегидроадамантан, полифторсодержащие эфиры.
Полифторированные диалкиловые эфиры являются малотоксичными (IV класс опасности) и озонобезопасными соединениями, которые могут использоваться в качестве вспенивателей, высокотемпературных теплоносителей, диэлектриков, как эффективные компрессионные, моторные, вакуумные, смазочные масла и присадки [1-4]. Введение адамантильного радикала в молекулу полифторированного эфира может существенно улучшить их эксплуатационные характеристики. Сведения о таких эфирах не многочисленны [5], отсутствуют исследования, как по синтезу, так и свойствам таких эфиров.
Авторами [5] полифторсодержащие эфиры адамантана были получены реакцией 1-гидроксиадамантана с полифторалкилхлорсульфитами:
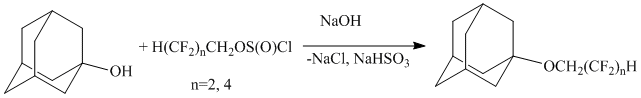
Реакция осуществлялась в среде диоксана в присутствии гидроксида натрия в течение 5-6 часов. Выход продуктов реакции составлял 76%.
Известна реакция 1-бромадамантана с алкоголятами полифторированных спиртов[5]:
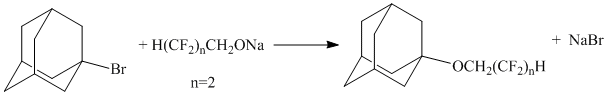
Реакцию проводили в среде бензола в течение 5-6 часов. Выход продуктов реакции составлял 73%.
Данные реакции протекают в несколько стадий и характеризуются большой продолжительностью 5-6 часов и сложным выделением продуктов.
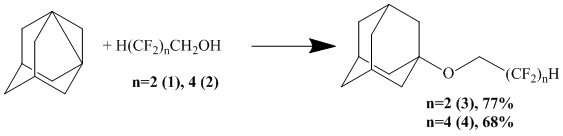
Нами был разработан удобный одностадийный метод получения таких эфиров реакцией 1,3-дегидроадамантана (ДГА) с полифторированными спиртами (ПС) общей формулы H(CF2)nCH2OH, где n=2,4.
В качестве исходных реагентов использовались 2,2,3,3-тетрафторпропиловый 1 и 2,2,3,3,4,4,5,5-октафторпентиловый 2 спирты.
Синтез осуществляли в среде тетрагидрофурана, в атмосфере сухого, очищенного от кислорода азота, при температуре 70°С, в течение 30 минут при мольном соотношении реагентов, равном 1:2.
В молекулах полифторированных спиртов H(CF2)nCH2OH присутствуют несколько реакционных центра, по которым может протекать взаимодействие с ДГА. Это гидроксильная группа, метиленовая группа СН2 (СН-кислотный центр), а также связи C-F.
Методом хромато-масс-спектрометрии установлено, что реакция ДГА с ПС протекает преимущественно по гидроксильной группе исходного спирта. По-видимому, это объясняется высокой кислотностью полифторированных спиртов (для спирта 1 рka=12,7 [6]), а также легкой протонируемостью молекулы ДГА [7].
В реакционной массе не обнаружены продукты взаимодействия ДГА по связи C-F. Подобное наблюдалось ранее в реакции ДГА с этиловым эфиром фторуксусной кислоты [8], в то время как, этиловые эфиры других галогенсодержащих кислот в такие реакции вступали [8,9]. Аналогичное наблюдалось и в реакциях с β-дикарбонильными соединениями, содержащими трифторметильную и дифторметильную группы [10]. Интересно, что 1,3-дегидроадамантан взаимодействовал по связи С-Hal с соединениями, содержащими атомы других галогенов (Hal = Cl, Вг, I) с образованием 3-Наl-1-R дизамещенных производных адамантана [11-15], и только по связи C-F-реакции также не протекали. По-видимому, это объясняется малым межатомным расстоянием связи C – F, а также более высокой энергией связи, превышающей энергию связей C - H и C – Нal ( Hal = Cl, Br, I).
Следовало предположить также образование продуктов реакции ДГА по С-Н кислотному центру полифторированных спиртов, так как С-Н кислотность СН2 - метиленовой группы должна быть достаточно высока, вследствие наличия двух электроноакцепторных заместителей: гидроксильной и полифторметиленовой. По-видимому, значительно более высокая О-Н кислотность гидроксильной группы и стерические затруднения для атаки метиленовой группы, снижают вероятность протекания реакции ДГА по данной группе. Следует отметить, что взаимодействие ДГА с полифторированными спиртами протекает без катализатора за короткое время (30 мин), в то время как аналогичная реакция с пероксиспиртами [16] общей формулы HO-(CH2)n-OO-Bu-t, протекает в присутствии кислотного катализатора за сравнительно большее время (180 мин), что также можно объяснить различием в кислотности ПС. В результате диссоциации гидроксильной группы ПС в растворе ТГФ, образующийся протон атакует ДГА с образованием адамантил-катиона, который легко рекомбинирует с гидроксильным анионом ПС с образованием эфирной связи.
Таким образом, ДГА селективно реагирует с ПС по гидроксильной группе с образованием простых эфиров: 1-адамантил-2,2,3,3-тетрафтор-пропилового (3, 77%) и 1-адамантил-2,2,3,3,4,4,5,5-октафторпентилового (4, 68%), которые были выделены вакуумной перегонкой. Это позволяет говорить о том, что реакция ДГА с ПС является удобным препаративным методом получения полифторсодержащих эфиров адамантана по узловому положению, позволяющим получать подобные соединения в одну стадию без образования побочных и сопутствующих веществ. Выделение продуктов реакции также значительно упрощается и сводится к отгонке растворителя и вакуумной перегонке продуктов, что уменьшает число стадий и, следовательно, потери продукта.
Состав и строение синтезированных веществ подтверждено ЯМР 1Н-спектроскопией и хромато-масс-спектрометрией. Свойства 3 и 4 соответствовали литературным данным [5].
Характерной особенностью масс-спектров синтезированных соединений является присутствие пика соответствующего адамантилкатиона с m/z 135 с интенсивностью 37%. При этом самыми интенсивными являются ионы с массой 209 (3) и 309 (4), который соответствуют фрагменту [М-С4Н9]+. Это означает, что основным направлением фрагментации 3 и 4 является расщепление адамантанового каркаса.
Анализ данных 1Н ЯМР-спектра подтверждает протекание О-адамантилирования, в 1Н ЯМР-спектре отсутствует сигнал протона гидроксильной группы.
Экспериментальная часть
Состав реакционной массы изучался на хромато-масс-спектрометре «Varian WS».
ЯМР 1Н-спектр получен на приборе «Varian» с рабочей частотой 300 МГц. В качестве растворителя использовался DMSO-d6.
Синтез адамант-1-ил-2,2,3,3-тетрафторпропилового эфира 3
К раствору 3,9 г (0,029 моль) 2,2,3,3-тетрафторпропилового спирта в 20 мл тетрагидрофурана при комнатной температуре по каплям прибавляли раствор 2,0 г (0,015 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл тетрагидрофурана. Раствор выдерживали 30 минут при Т=70°С. Растворитель отгоняли, продукт выделяли вакуумной перегонкой. Получено 3,1 г (77%), бесцветная жидкость, т.кип. 62°С/1мм, nd15 = 1,4428. Литературные данные nd20 = 1,4440 [5]. Масс-спектр, m/z (интенсивность, %): 266, 35% [M]+; 209, 100% [M–С4Н9]+; 151, 1% [AdO]+, Ad – 1-адамантил; 135, 37% [Ad]+; ЯМР 1Н–спектр, δ, м.д.: 1,44¸1,73 м (12H, Ad); 2,11 с (3H, Ad); 3,69 с (2H, CH2CF2); 5,7 с (1H, HCF2).
Синтез адамант-1-ил-2,2,3,3,4,4,5,5-октафторпентилового эфира 4
Аналогично, к раствору 7,3 г (0,03 моль) 2,2,3,3,4,4,5,5-октафторпентилового спирта в 20 мл тетрагидрофурана прибавляли раствор 2,1 г (0,016 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл тетрагидрофурана. Раствор выдерживали 30 минут при Т=70°С. Растворитель отгоняли, продукт выделяли вакуумной перегонкой. Получено 3,9 г (68%), бесцветная жидкость, т.кип. 81°C/1 мм, nd15 = 1,4434. Литературные данные nd20 = 1,4442 [5]. Масс-спектр, m/z (интенсивность, %): 366, 28% [M]+; 309, 100% [M–С4Н9]+; 151, 2% [AdO]+; 135, 37% [Ad]+.
Физико-химические свойства и параметры ЯМР 1Н-спектров синтезированных соединений коррелируют с приведенными в работе [2].
Список литературы
2. Промышленные фторорганические продукты: Справочник. Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др. Л.:Химия, 1990.-464с
3. Murata, J.; Yamashita, S. ; Akiyama, M.; Katayama, S. ; Hiaki, T.; Sekiya, A. Vapor Pressures of Hydrofluoroethers. // J. Chem. Eng. Data 2002, 47, 911- 915.
4. Sekiya, A.; Misaki, S. The potential of hydrofluoroethers to replace CFCs, HCFCs and PFCs. J. Fluorine Chem. 2000, 101, 215-221.
5. Синтез 1-полифторалкоксипроизводных адамантана. Рахимов А.И., Вострикова О.В. // Журнал общей химии. 2011. Т. 81. № 2. С. 274-276.
6. Химическая энциклопедия: В 5 т.: т.4: / Редкол.: Зефиров Н.С. и др..-М.: Большая Российская энцикл., 1995.-639с.
7. Багрий Е.И. Адамантаны. -М. : Наука, 1989. - 290 с.
8. Взаимодействие 1,3-дегидроадамантана с эфирами α-галогенкарбоновых кислот. Г.М. Бутов, В.М. Мохов, С.В. Дьяконов // Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып. 4, №5/ ВолгГТУ. – Волгоград, 2007.- С. 30-34.
9. Пат. №2301796, С07С 67/30, 69/635. Г.М. Бутов, В.М. Мохов, С.В. Дьяконов. Способ получения 3–галоген–1– (этоксикарбонил)алкиладамантанов. Заявлено 17.04.2006 Опубл. 27.06.2007 Бюл. №18.
10. Исследование взаимодействия 1,3-дегидроадамантана с алифатическими фторированными b-дикетонами. Бутов Г.М., Мохов В.М., Паршин Г.Ю., Кунаев Р.У. // Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып.4, №5/ ВолгГТУ.– Волгоград, 2007.-С.25- 27.
11. Способ получения (3-бромадамант-1-ил)алкил- или арилкетонов. Г.М. Бутов, В.М. Мохов, С.В. Дьяконов, Р.У. Кунаев // Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып. 5, №1/ ВолгГТУ. – Волгоград, 2008.- С. 41-43.
12. Способ получения З-хлорадамант-1-илалкилкетонов Г.М. Бутов, С.В. Дьяконов, Г.Ю. Паршин, В.М. Мохов // Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып. 6, № 2. / ВолгГТУ. - Волгоград, 2009. - С. 40-42.
13. Необычное взаимодействие 1,3-дегидроадамантана с 3-бром-1,77- триметилбицикло[2.2.1]гептан-2-оном Г.М. Бутов, В.М. Мохов, Г.Ю. Паршин, Р.У. Кунаев // ЖОрХ. - 2007. - № 8. - т. 43. - С. 1256-1257.
14. Взаимодействие 5,7-диметил-1,3-дегидроадамантана с камфорой и бромкамфорой Бутов Г.М., Мохов В.М., Паршин Г.Ю., Кунаев Р.У.// Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып.4, №5/ ВолгГТУ.– Волгоград, 2007. - С. 22-24.
15. О взаимодействии хлорангидридов ароматических карбоновых кислот с 1,3-дегидроадамантаном Г.М. Бутов, В.М. Мохов, С.В. Дьяконов // Известия ВолгГТУ: межвуз. сб. науч. ст. (Сер. Химия и технология элементорганических мономеров и полимерных материалов). Вып. 8, № 2 / ВолгГТУ. - Волгоград, 2011. - C. 27-28.
16.Синтез простых 1-адамантиловых эфиров пероксиспиртов Б.И. Но, Г.М. Бутов, С.М. Леденев. // ЖОрХ. - 1992. - № 3. - т. 28. - С. 606-607.
Материал рекомендован к публикации членом редколлегии проф. А.И. Рахимовым
Fluorine Notes, 2012, 82, 11-12
