Received: ноябрь 2011
Fluorine Notes, 2012, 82, 5-6
Определение констант скоростей реакций получения перфторэтилизопропил кетона с использованием проточного конического аппарата
И.М. Феничев, Ю.И. Бабенко, Т.А. Биспен, Д.Д. Молдавский, В.И. Мануйлова
Федеральное Государственное Унитарное Преприятие "Российский Научный Центр "Прикладная химия"
193232, Санкт-Петербург, ул..Крыленко 26 лит. А.
e-mail: htf1352501@rambler.ru
Аннотация. Предложена методика определения константы скорости брутто – реакций получения перфторэтилизопропил кетона взаимодействием окиси гексафторпропена или фторангидрида перфторпропионовой кислоты с гексафторпропеном путём осуществления процесса в проточном коническом аппарате. Найдены константы скоростей обеих газовых реакций.
Ключевые слова: Префторэтилизопропил кетон, константы скорости, конический аппарат, промежуточный комплекс, перфторпропионат цезия.
При поиске рациональных методов получения перфторэтилизопропил кетона, C2F5–C(O)–CF(CF3)2, (далее кетон) мы установили, что последний может быть получен реакцией гексафторпропена (далее пропен) с фторангидридом перфторпропионовой кислоты (далее фторангидрид) или реакцией гексафторпропена с окисью гексафторпропена (далее окись) в присутствии катализаторов КF или CsF:
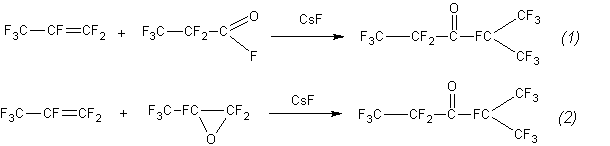
Оба процесса взаимозаменяемы и протекают в одинаковых условиях (катализатор, температура, времена контакта, выход кетона, состав и соотношение примесей). Случай весьма редкий в химической практике. Для исследования этого феномена мы определили константы скорости обеих реакций и предложили механизм взаимодействия.
Для случая, когда необратимая бимолекулярная реакция в газовой фазе идёт в замкнутом объёме с сохранением числа молей по схеме:
А + В → С + D, (3)
определение константы скорости реакции не представляет труда, так как соответствующая система кинетических уравнений интегрируется, и указанная константа может быть найдена, например, по конверсии исходных продуктов [1].
Когда процесс происходит в трубчатом проточном реакторе, система кинетических уравнений сохраняет вид, если вместо времени реакции t использовать понятие “время пребывания”, которое определяется выражением t = x/u (x – текущая координата, u – линейная скорость газа).
Однако, если газовая реакция идёт, как в нашем случае, в замкнутом объёме с уменьшение числа молей по схеме (4)
А + В → С, (4)
простейшая кинетическая модель неприменима, так как молярные концентрации отдельных веществ изменяются не только из-за химического взаимодействия, но так же из-за уменьшения плотности смеси в ходе реакции, что усложняет обработку экспериментальных данных. При этом можно определить константу скорости только по начальным участкам кинетических кривых, когда плотность смеси близка к исходной, однако при этом теряется информация о характере процесса при больших конверсиях.
В настоящей работе указан относительно простой способ устранения указанной трудности с помощью использования соответствующей аппаратуры.
Методика определения константы скорости реакции, идущей с уменьшением удельного объёма
Положим, что газовая реакция (4) осуществляется в замкнутой ёмкости, объём которой синхронно уменьшается с уменьшением удельного объёма. При этом систему кинетических уравнений можно записать следующим образом:
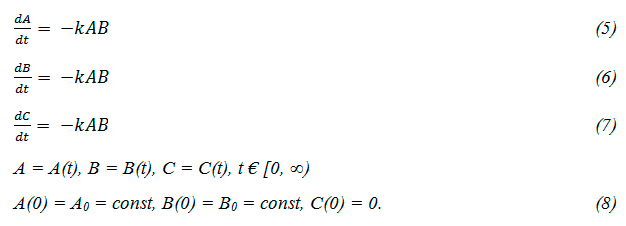
Здесь А,В,С – молярные концентрации соответствующих веществ, t – время, k – константа скорости реакции. В исследуемом нами процессе начальные концентрации исходных веществ одинаковы (А0 = В0). Очевидно, что при любых значениях t имеем A(t) = B(t). Поэтому вместо (5) можно записать:
![]()
Интегрируя последнее, находим
![]()
Складывая уравнения (5) и (7), и интегрируя, получаем
![]()
Из (10) и (11) следует

На практике кинетическую константу удобно определять по конверсии исходных соединений ξ (в нашем случае ξ1 = ξ2):
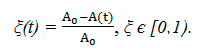
Из (10) находим
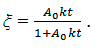
Отсюда следует основная формула определения кинетической константы:

Разумеется, реализовать на практике устройство, автоматически уменьшающее объём по мере прохождения реакции, достаточно сложно. Однако это затруднение легко преодолеть, если осуществлять процесс в проточном реакторе конической формы, площадь входного сечения которого примерно вдвое больше выходного. Предполагается, что величина конверсии близка к единице. При этом в выражении (13) под величиной t следует подразумевать время пребывания элементарного объёма, движущегося вместе с потоком t = l/ u, где l – длина канала реактора.
О гидродинамике процесса
Если процесс в проточном реакторе идёт с уменьшением удельного объёма, возможна потеря устойчивости прямолинейного течения при значениях числа Рейнольдса значительно меньших обычного Re ≈ 2200. При этом возникают циркуляционные токи и простая расчётная формула (13) становиться неприменимой. Этот вопрос теоретически исследован в работе [2]. Критерий потери устойчивости в прямолинейном канале имеет вид:

Здесь ρ – плотность, r – радиус канала, v – средняя кинематическая вязкость.
В такой форме указанный критерий не связан непосредственно с числом Рейнольдса, а зависит (в основном) от относительного изменения плотности смеси Δp/p0 на расстояние, имеющим порядок длины реактора
![]()
Комбинируя (14) и (15) и, принимая во внимание, что Re = 2ur / v,
![]()
Константа здесь не определена, так как равенство (15) приближённое, однако очевидно, что её величина имеет прежний порядок.
Если канал имеет форму сужающегося конуса, то течение более стабильно, нежели в прямолинейной трубе [3]. Таким образом, имеет место “эффект компенсации” и значения критерия превышает величину 5,76.
Поскольку в исследованном нами случае реактор содержал насыпной катализатор, имеем r ≈ 10-3. В таком узком канале значение 5,76 заведомо не достигается. Следовательно, циркуляционные токи не возникают. Однако, если бы засыпка отсутствовала, “гладкий” режим течения мог бы не реализоваться, особенно в большом промышленном реакторе. Поэтому конический реактор может найти применение не только для определения константы скорости, но и для стабилизации потока в аппарате проточного типа. Конструкция реактора запатентована авторами в РФ [4].
Экспериментальная часть
Жидкая смесь гексафторпропилена и окиси гексафторпропилена или гексафторпропилена и фторангидрида перфторпропионовой кислоты в мольном соотношении 1,02 ÷1,05 : 1 поступала с определённой скоростью в испаритель, представляющий собой трубку из стали 12Х18Н10Т, длиной 300 и диаметром 28 мм и нагретую до температуры начальной зоны реактора, после чего поступала в реактор. Реактор сварен из трёх коаксиальных трубок из стали 12Х18Н10Т длиной 235 мм каждая и внутренними диаметрами 28, 23 и 17 мм соответственно. Реактор снабжён тремя карманами для термопар, регулировочными кранами, манометром, двумя регулируемыми зонами обогрева – 250 и 450 мм соответственно. Реактор заполнялся углём БАУ-2, содержащим 20% масс CsF. Давление в реакторе поддерживалось 0,22 – 0,25 МПа (при этом давлении минимизировано образование побочных продуктов). Продукты реакции собирались в ловушке из стали 12Х18Н10Т, охлаждаемой жидким азотом. Продукты реакции взвешивались и анализировались методом ГЖХ (прибор “Кристалл 2000М”, колонка 2м, силохром +20% α, α, α – трисбетацианэтоксиацетофенон, детектирование по теплопроводности, газ-носитель He).
Этот же реактор использовался для изучения изомеризации окиси гексафторпропилена в ангидрид.
Экспериментальные данные и расчётная константа скорости
В приведённых ниже таблицах Q – полный расход смеси на входе в реактор, t – время пребывания. Расчёт константы скорости реакции выполнен по формуле (13).
Таблица 1. Реакция гексафторпропилена и окиси гексафторпропилена
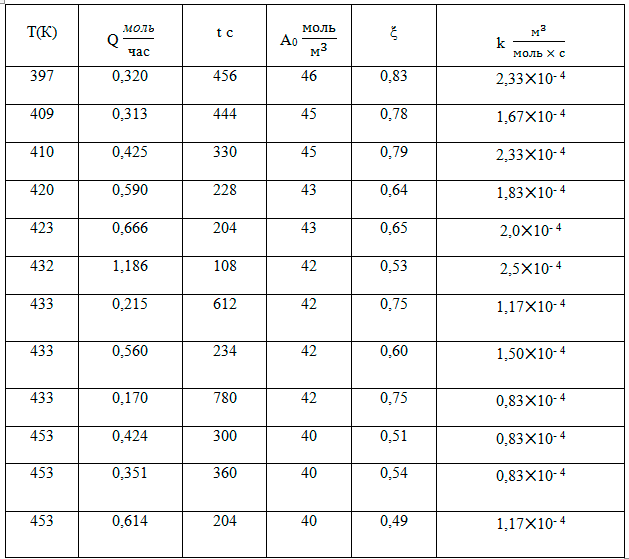
Таблица 2. Реакция гексафторпропилена и фторангидрида перфторпропионовой кислоты
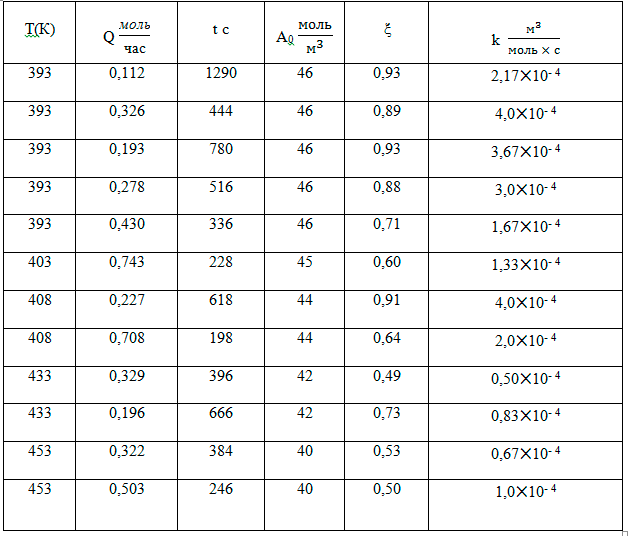
Несмотря на значительный разброс численных значений константы скорости реакции, прослеживается обратная зависимость брутто-реакции от температуры. Это означает, что процесс идёт через промежуточный комплекс (перфторпропионат цезия), который затем реагирует со вторым компонентом - гексафторпропиленом [5]. Подобные процессы встречаются достаточно часто [6]. Таким образом, формальная схема (4) не даёт возможности найти величину k в виде k = k0 exp(-E/RT).
Получены также единичные данные для константы скорости при различных давлениях в интервале 1 ÷ 4,5x105 Па. При этом наблюдается обратная зависимость скорости реакции от давления, что также свидетельствует об образовании промежуточного комплекса.
Полученная информация, несмотря на ограниченность, позволила осуществить проектирование и создание промышленного реактора получения кетона на опытном заводе ФГУП РНЦ “Прикладная химия”.
Отметим одну особенность полученных результатов. В пределах полученных разбросов численных значений полученных констант последние близки для обеих исследованных реакций. Близость констант скорости реакций (1) и (2), а также обратная зависимость константы от температуры указывает на следующий механизм взаимодействия первой быстрой стадией процесса является образование перфторпропионата цезия [7,8]:
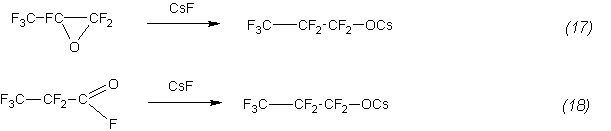
Затем пропионат реагирует с гексафторпропиленом, образуя кетон:
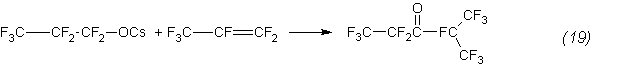
Дополнительным подтверждением этому служит, в частности, изомеризация окиси гексафторпропилена в ангидрид, количественно протекающая уже при 85°С:
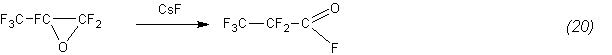
Выводы
- Предложена методика определения константы скорости брутто – реакций получения перфторэтилизопропил кетона путём осуществления процесса в проточном коническом аппарате.
- С помощью предложенной методики найдены константы скорости двух газовых реакций.
- Близкие значения констант скорости обеих реакций подтверждают гипотезу о том, что реакции идут через один и тот же промежуточный комплекс, скорость образования которого существенно больше скорости распада.
Литература
- Е.Т. Денисов. Кинетика гомогенных химических реакций. М. “Высшая школа”, 1978. – 368.
- Бабенко Ю.И.О возникновении турбулентного режима течения при наличии химической реакции. Инж.-физ. Ж. 1986. Т.50.N2. Деп. в ВИНИТИ 29.08.85,рег. N 6424-85 Деп.
- Кочин Н.Е., Кибель И.А., Н.В. Розе. Теоретическая гидромеханика. Часть 2.М.,ГИФМЛ,1963.
- Пат. РФ. N 107073 от 10.08.2011.
- R. D. Smith, F. S. Fawcett, D. D. Coffman, J. Amer, Chem, Soc., 84, 4285 (1962)
- Р. Шмид, В.Н. Сапунов. Неформальная кинетика. В поисках путей химических реакций : Пер. с англ. – М.: Мир, 1985. – 264 с., ил.
- R. D. Chambers e. a. J. Chem. Soc., C, 1968, 2221.
- W. Brunsgill e. a. J. Chem. Soc. Chem. Comm., 1970, 1444.
Материал рекомендован к публикации членом редколлегии В.В. Корниловым
Fluorine Notes, 2012, 82, 5-6
