Received: июнь, 2011
DOI 542.91 + 542.944 + 542.945 + 547.221 + 547.35 + 547.539.1
Fluorine Notes, 2012, 80, 1-2
Синтез и применение полифторированных органических производных бора и кремния для получения иодониевых, бромониевых и ксенониевых солей
В.В. Бардин
Учреждение Российской академии наук Новосибирский институт органической химии им. Н.Н.Ворожцова
Сибирского отделения РАН, 630090, Новосибирск, пр. Лаврентьева, 9.
e-mail: bardin@nioch.nsc.ru
Аннотация. В обзоре рассмотрены методы получения полифторорганических силанов, боранов и боратов, и их использование в синтезе солей [RFXeFn][A], [RFR'FBr][A] и [RFR'FIFn][A].
Ключевые слова: Органобораны, Органобораты, Органосиланы, Соли иодония, Соли бромония, Соли ксенония.
Оглавление
I. Введение
II. Синтез полифторированных органилборанов,
-боратов и -силанов
III. Синтез солей полифторированных производных брома (III, V), иода
(III, V) и ксенона (II, IV)
I. Введение
Особенностью химии полифторированных элементоорганических соединений является её принадлежность к числу "пограничных" наук, которые включают типичные особенности каждого из основных направлений и специфические качества, свойственные лишь данной области знаний. Это в полной мере относится к органическим производным поливалентных иода и брома. Методы получения и реакционная способность этих соединений хорошо изучены и изложены в многочисленных обзорах и фундаментальных монографиях. Их полифторированные аналоги изучены значительно меньше, и лишь недавно сведения о них были систематезированы в обзоре [1]. Достоверные сведения о синтезе ксенонорганических соединений впервые появились в 1989 году, когда две группы немецких учёных независимо опубликовали получение солей [C6F5Xe][(C6F5)nBF4-n] [2, 3]. В ходе поисковых исследований выявилась перспективность использования реакций переноса органического фрагмента R от атома кремния или бора на атом ксенона в молекуле XeF2, иода или брома в R'EF2 (E=Br, I; R' = F или органическая группа). В данном обзоре проанализировано применение этих реакций в препаративном синтезе солей перфторорганилксенония(II, IV), симметричных и несимметричных солей бромония(III) и иодония(III, V) с перфторированными органическими группами у атома галогена.
II. Синтез полифторированных органилборанов, -боратов и –силанов
1. Производные бора
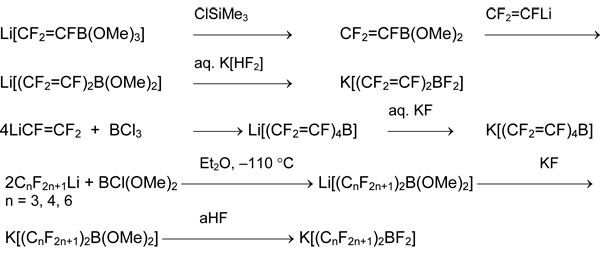
Первоначально соли полифторарилксенония и -иодония получали из фторсодержащих триарилборанов. Процедура синтеза и особенно, очистки этих предшественников сложна, а продуктом реакции являлись соли анионов [ArnBF4-n]–. Альтернативой стало использование боранов RBF2. Для их получения была разработана общая схема, включающая синтез полифторорганил(алкокси)боратов и полифторорганил(фтор)боратов. Ключевой стадией процесса является нуклеофильное присоединение полифторорганиллития (или бромида полифторорганилмагния) к три(алкокси)борану:
RFM + B(OAlk)3 → M[RFB(OAlk)3]
M = Li, MgBr; RF = CnF2n+1, RCF=CF, CF2=CR, RC≡C, C6HnF5-n (n = 1-5)
Соли M[RFB(OAlk)3] могут быть выделены в чистом виде [4-9], но для получения производных борной кислоты [8, 10] или фторборатов [11-19] их часто используют без выделения из раствора.
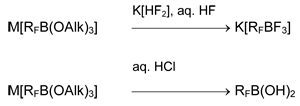
На основе этой схемы разработаны методы получения перфторированных борорганических веществ, содержащих 2-4 органических фрагмента у атома бора [5, 18, 20].
Важным свойством органилфторборатов является способность отщеплять фторид анион под действием кислот Льюиса, давая соответствующие органилфторбораны. Хотя сродство к фториду в газовой фазе (pF–) боранов RFBF2 составляет 8.51 (RF = C6F5), 8.0–9.0 (RF = CF3CF=CF), 8.90 (RF = CF3C≡C) и превосходит таковое BF3 (7.88) [21], барботирование трифторида бора в суспензию K[RFBF3] в дихлорметане или полифторуглеводородах приводит к раствору RFBF2 [11,12,16,17,22-24]. По-видимому, движущей силой процесса является высокая энергия кристаллической решетки осаждающегося K[BF4].
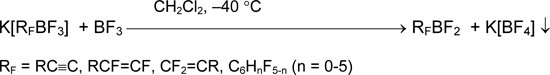
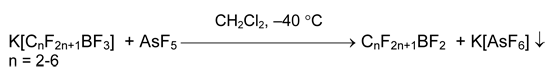
Для дефторидирования перфторалкилтрифторборатов до перфторалкилдифторборанов (pF–~9.6) требуется более сильная кислота Льюиса, например, AsF5 [14].
Органилдифторбораны хорошо растворяются в неполярных растворителях, и после декантации их растворы можно использовать для последующих реакций. Этот метод применим к боранам с углеводородными группами R и к их перфторированным аналогам [11,12,14,16,17,22-24].
Более подробно свойства полифторированных фторборанов и фторборатов рассмотрены в обзорах [25, 26].
2. Производные кремния
Полезными предшественниками являются полифторарилсиланы ArFSiAlk3 и ArFSiF3. Для синтеза первых из них удобна реакция полифторарилбромидов и –иодидов с ClSiAlk3 и трис(диалкиламино)фосфином. Целевые продукты ArFSiAlk3 быстро образуются при комнатной температуре в среде алифатических или ароматических углеводородов, простых и сложных эфиров (серный эфир, диглим, ТГФ, этилацетат), дихлорметана или ацетонитрила [27-31].

Использование триалкилгалогенидов германия, олова или свинца вместо ClSiAlk3 позволяет получать соответствующие элементоорганические соединения.

Интересно, что в присутствии протонодонорных субстратов происходит замещение галогена водородом (восстановление) [27, 32].

Гексафторбензол не вступает в реакцию с ClSiAlk3 и P(NAlk2)3. Однако замена одного атома фтора в гексафторбензоле более электроноакцепторным заместителем позволила осуществить реакции силилдефторирования и гермилдефторирования подобно замещению атомов брома или иода [33, 34].
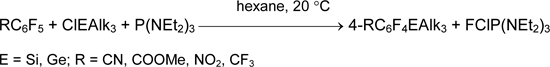
В ряду нефторированных или малофторированных ароматических соединений такие реакции не идут. Но этот подход пригоден для синтеза перфторированных алкенилсиланов и циклоалкенилсиланов [35].
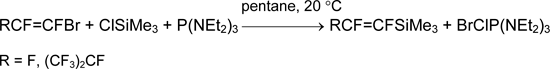
Попытки пентафторфенилирования тетрагалогенидов SiCl4, GeCl4 и GeBr4 с помощью P(NEt2)3 не дали желаемых результатов. Для получения соединений C6F5SiX3 (X= F,Cl,Br) были разработаны иные методы, основанные на замещении этоксильных групп в сравнительно доступном силане C6F5Si(OEt)3 [36].
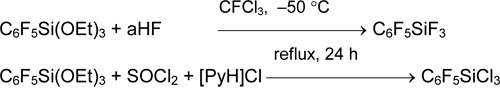
Пентафторфенилсодержащие фтор-, хлор- и бромсиланы общей формулы (C6F5)nSiMemX4-n-m предложено получать расщеплением связи Si-Ph в соответствующих фенилсиланах действием безводного HF (aHF) или HSO3F (X = F), безводного HCl (aHCl) и AlCl3 (X = Cl) или AlBr3 в дибромэтане. Синтезы идут в мягких условиях и с хорошими выходами [37, 38].
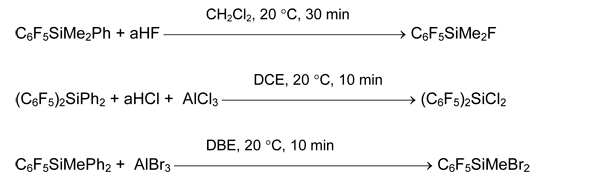
Арил(фтор)силаны и -германы получаются из соответствующих хлор- или бромпроизводных действием SbF3, NbF5 [36] или лучше, Na2[SiF6] [39].
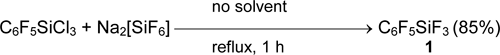
Силан 1 является более слабым акцептором фторид аниона, чем боран 2. Его сродство к фторид аниону в газовой фазе (pF–) составляет 7.45, а для борана C6F5BF2 8.51. Для сравнения, сродство к фторид аниону бинарных фторидов BF3 и SiF4 равно 7.88 и 7.18, соответственно. Замена атомов фтора у гетероатома алкильными группами заметно ослабляет силу кислоты Льюиса. Так, значение pF– силана C6F5Si(CH3)3 составляет 4.92 [21].
III. Синтез солей полифторированных производных брома(III, V), иода(III, V) и ксенона(II, IV)
1. Производные брома(III)
Действием трифторида брома на C6F5SiMe3 (3) (1 экв.) в дихлорметане получается пентафторфенилдифторброман (4) с выходом 58%. Соль бис(пентафторфенил)бромония не образуется даже в избытке C6F5SiMe3 и в присутствии BF3•OEt2 [40].
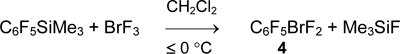
Аналогично реагирует с BrF3 пентафторфенилтрифторсилан (1) при температуре ниже –60°С. Скорость дальнейшей реакции становится заметной при температуре выше –30°С, и в результате соль [(C6F5)2Br][SiF5] получается с выходом 92%.
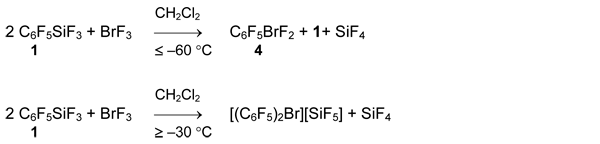
Полифторорганилбораны - более сильные акцепторы фторид аниона (II.1) и при взаимодействии с BrF3 в слабокоординирующих растворителях образуются симметричные бис(перфторорганил)бромониевые соли.
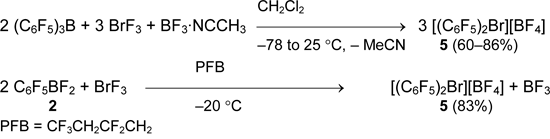
Отметим, что соль 5 образуется даже в эквимолярной реакции пентафторфенилдифторборана 2 с BrF3, а образования C6F5BrF2 не зафиксировано при температуре –60°С [40].
Метод получения тетрафторбората бис(пентафторфенил)бромония был успешно применён в синтезе представительной серии бис(перфторорганил)бромониевых солей, содержащих алкенильные и алкинильные группы.

Получить или зафиксировать бис(перфторгексил)бромониевую соль в реакции C6F13BF2 с BrF3 не удалось.
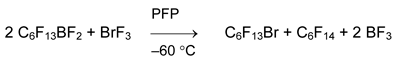
Для синтеза несимметричных фторсодержащих бис(арил)бромониевых солей использовали реакции арилдифторброманов с арилтрифторсиланами [41].
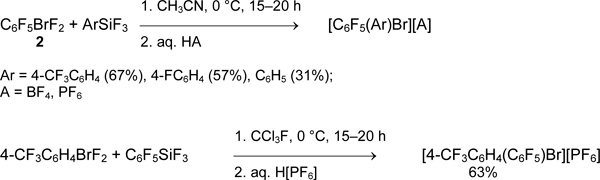
Можно ожидать, что арилдифторброманы также будут вступать в реакцию с алкенил- и алкинилтрифторсиланами, однако последние труднодоступны и данных о таких исследованиях нет.
Напротив, полифторированные алкенилдифторбораны и алкинилдифторбораны получаются легко (II.1). Действием на них броманов ArBrF2 синтезированы соли перфтор(арил)(алкенил)бромония и перфтор(арил)(алкинил)бромония.
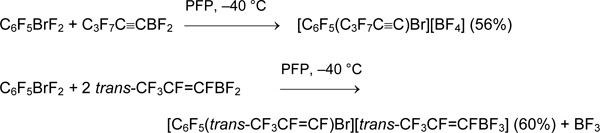
Попытки синтеза перфторированных солей фенил(гексил)бромония и (пентафторфенил)(1H,1H,2H,2H-тридекафтороктил)бромония окончились неудачей.
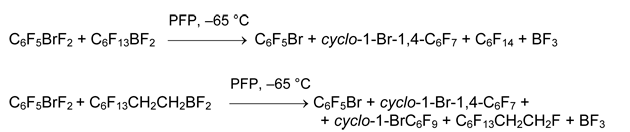
Следует отметить, что органил(фтор)бромониевые соли [RBrF][A] в рассмотренных выше реакциях не зарегистрированы и в литературе не описаны. В работе [42] изучено взаимодействие C6F5BrF2 с BF3 в слабокоординирующем растворителе (SO2FCl) и в основном растворителе (CD3CN + CD2Cl2). В первом случае наблюдали быстрое разложение 4 с образованием C6F5Br и продуктов фторирования последнего. Во втором случае обнаружен комплекс [C6F5BrF •(NCCH3)n][BF4] (ЯМР 19F), который разлагается при нагревании раствора до 22°С.
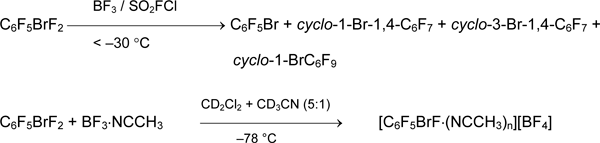
2. Производные брома(V)
В отличии от производных брома (III), соли органилброманов (V) не описаны, но известны ковалентные арилброманы ArBrF4. Взаимодействием пентафторфенилтриметилсилана с пентафторидом брома в присутствии MeCN получен пентафторфенилтетрафторброман с выходом 66%. Аналогично реагируют бис(пентафторфенил)диметилсилан и 4-трифторметилфенил-триметилсилан [43].
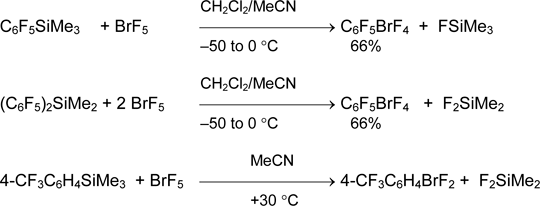
Замена арилтриметилсилана арилтрифторсиланом (более сильная кислота Льюиса) не меняет направление реакции и характер продукта. В избытке основания или без него получаются только продукты фторирования ароматического кольца [43, 44].
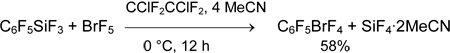
Этим способом синтезирован броман 3-CF3C6H4BrF4 из BrF5 и комплексов 3-CF3C6H4SiF3•2Py или (3-CF3C6H4)2SiF2•2Py. В то же время соответствующие арилтетрафторброманы FC6H4BrF4 получаются из 2-FC6H4SiF3•2Py и 4-FC6H4SiF3•2Py с очень низким выходом [43].
![]()
3. Производные иода(III)
Удобный метод получения солей арил(полифторалкил)иодония и алкинил(полифторалкил)иодония предложен Жданкиным [45-47]. Он состоит в обработке полифторалкильных производных иода (6) арилтриметилсиланом или алкинилтриметилсиланом в дихлорметане.
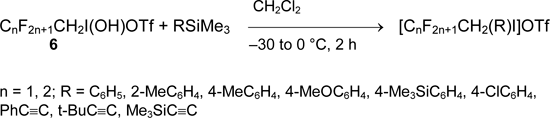
Перфторалкильные производные (7) менее реакционноспособны и образуют соответствующие арил(перфторалкил)иодониевые соли только в присутствии Me3SiOTf. Алкинилтриметилсиланы с ними не реагируют.
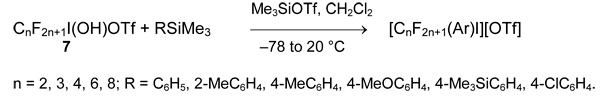
Этот метод ограничен использованием силанов RSiMe3 с электронодонорными заместителями R. Более универсальным является способ, основанный на взаимодействии органилдифториоданов RIF2 с триарилборанами или лучше, органилдифторборанами R'BF2. В первом случае получаются арил(полифторарил)иодониевые соли [48-50].
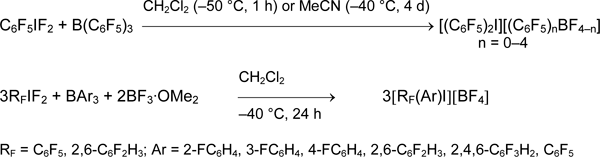
С помощью боранов получаются симметричные и несимметричные соли, содержащие арильные, алкенильные, алкинильные группы в разных комбинациях. Более того, можно использовать разные пары реагентов RIF2/R'BF2 или R'IF2/RBF2 в зависимости от их доступности [4, 21, 51, 52].
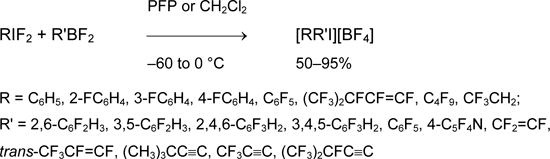
Таким способом впервые получена перфторированная арилалкилиодониевая соль [53].

4. Производные иода(V)
Силан 1 не реагирует с избытком IF5 и его растворами в CH2Cl2, фторхлоруглеродах или в безводном HF [36, 54], но в ацетонитриле даёт пентафторфенилтетрафториодан (8) с количественным выходом [54]. Этот иодан получается также из пентафторфенилтетрафторсиликата тетраметиламмония [55].
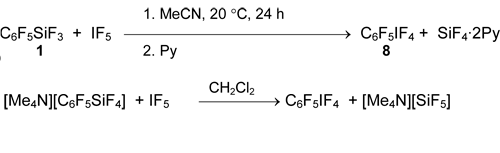
Соль пентафторфенилтрифториодония 9 здесь не образуется, но она может быть генерирована действием SbF5 в SO2FCl [42, 56].
![]()
Соли перфторалкилтетрафториодана не описаны и по-видимому, очень нестабильны. Например, обработка перфторгексилтетрафториодана пентафторидом мышьяка ведет к расщеплению связи углерод-иод и образованию перфторгексана с количественным выходом [42].

Интересно, что действие [IF4][SbF6] на силан 1 во фторсульфоновой кислоте ведет не к соли 9, а к соли бис(пентафторфенил)иодония [36].
![]()
Боран 2 очень медленно реагирует с пентафторидом иода в CH2Cl2 при 20 °С, давая смесь C6F5IF4, [(C6F5)2IF2][BF4] и продуктов побочных реакций (C6F5I, C6F5H, CH2ClF). Быстрее протекает его реакция с иоданом 8, которая приводит к тетрафторборату бис(пентафторфенил)дифториодония [57].

5. Подходы к получению производных иода(VII)
Неорганические соединения иода (VII) исследованы меньше, чем производные иода (III) и иода (V), а органические соединения иода (VII) не описаны. В работе [58] изучены некоторые подходы к RFIF6, основанные на использовании бор- и кремнийорганических синтонов и IF7. Но в отличии от рассмотренных выше случаев, реакция гептафторида иода с C6F5SiMe3 или C6F5SiF3 в PFP дает только продукты фторирования ароматического кольца. Замещение кремния атомом иода происходит в реакции соли [Me4N][C6F5SiF4] с IF7, но продуктами являются производные иода(V).
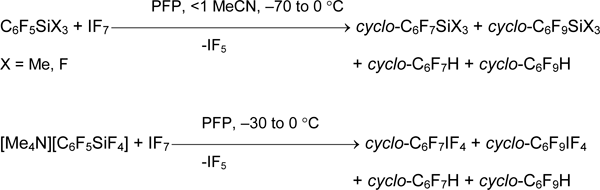
Подобным образом протекает взаимодействие IF7 с бораном 2 и даже с дибораном 1,4-C6F4(BF2)2, который содержит две сильные электроноакцепторные группы в тетрафторфенильном кольце [σI (BF2) = 0.15, σR (BF2) = 0.30, σm (BF2) = 0.45, σp (BF2) = 0.37] [11].
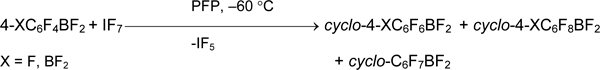
Анализ относительных скоростей реакции C6F5SiX3 и C6F5BF2 с HalFn (Hal = Br, I; n = 3, 5) показал их уменьшение с возрастанием n. Это является одной из наиболее вероятных причин отсутствия замещения атома бора или кремния на атом I(VII). Т.е. скорость иоддеборирования действием IF7 ниже, чем скорость параллельной реакции фторирования полифторароматического кольца.
6. Производные ксенона(II, IV)
Первые сообщения об успешном препаративном синтезе соединений со связью углерод-ксенон опубликованы в 1989 году [2, 3]. Незадолго до них появилась работа [59], где была описана реакция перфторарилтриметилсиланов ArFSiMe3 с дифторидом ксенона в присутствии фторида цезия при 20°С (гетерогенная реакция). Помимо ксенона и фтортриметилсилана, её продуктами были арены и диарилы. Аналогично происходит реакция XeF2 с Cs[C6F5SiF4] [55].
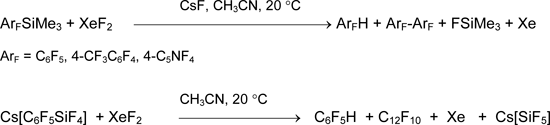
Образование ксенонорганических веществ не было доказано. Причины стали понятны позднее после изучения свойств заведомых солей [C6F5Xe][AsF6] и ковалентных соединений C6F5XeF или (C6F5)2Xe. Оказалось, что органические соединения двухкоординированного ксенона значительно менее устойчивы, чем соли, и в ацетонитриле распадаются по радикальному механизму, давая C6F5H и C12F10 [60, 61]. Когда реакцию C6F5SiMe3 с XeF2 и [Me4N]F провели нагреванием гомогенного раствора в MeCN-EtCN от –60 до –40 °С с последующим быстрым охлаждением, то C6F5XeF и (C6F5)2Xe зарегистрировали с помощью спектроскопии ЯМР 19F и 129Xe. Но соединения ксенона с трифторметильными группами нестабильны даже при низкой температуре. Так, из CF3SiMe3 в этих условиях получили только гексафторэтан, ксенон и FSiMe3 [62].
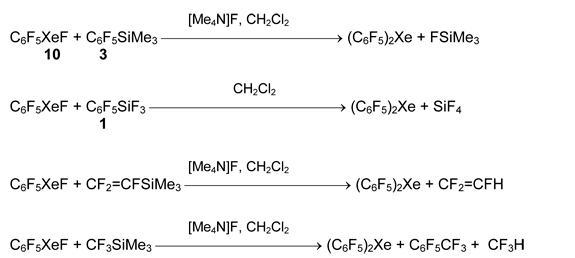
Похожий подход был использован для получения бис(пентафторфенил)ксенона из пентафторфенилфторксенона 10 и силанов 1 и 3. Неожиданно, образование этого соединения обнаружено в реакции 10 с силанами CF3SiMe3 и CF2=CFSiMe3 в присутствии [Me4N]F [63].
Практически полезные результаты в препаративном синтезе ксенонорганических соединений получены при использовании в качестве переносчиков органической группы соединений бора. Первоначально это были триарилбораны, но из-за сравнительно высокой нуклеофильности анионов [(XC6H4)nBF4-n] эти соли разлагаются в растворе при –60 ÷ –20 °С.
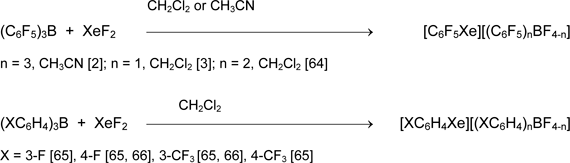
Улучшенным вариантом явилась реакция в присутствии эфирата трифторида бора. Роль последнего состоит в замене сравнительно хороших доноров фторид аниона [ArnBF4-n]– низконуклеофильными анионами [BF4]–, что существенно увеличивет стабильность солей [ArXe][A].
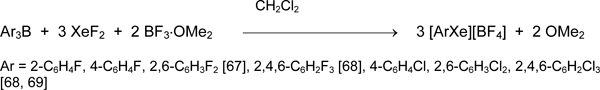
Значительный прогресс в исследовании ксенонорганических соединений был достигнут при использовании органилдифторборанов RFBF2 как источников RF. Был разработан простой и удобный препаративный метод синтеза тетрафторборатов полифторорганилксенона(II), содержащих у атома ксенона арильные, алкенильные и алкинильные группы [12, 16, 17, 70-75].
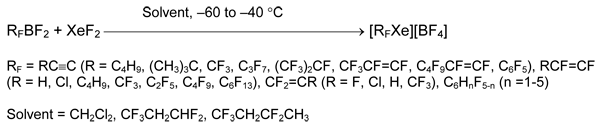
Метод имеет некоторые ограничения. Так, при взаимодействии XeF2 с 4-тетрафторпиридилдифторбораном вместо ожидаемой соли тетрафторпиридилксенония (II) получился, предположительно, комплекс 4-C5NF4BF2•XeF2 [21]. Не удалось получить производные алкилксенония. В реакции C6F13BF2 с XeF2 образуются перфторгексан, ксенон и трифторид бора, а из C6H13BF2 - в основном гексилфторид.
Реакция борана 2 с тетрафторидом ксенона протекает заметно медленнее и даёт соль пентафторфенилдифторксенония [76].

Альтернативный подход состоит в электрофильном замещении гетероатома, входящего в состав очень хорошей уходящей группы. В этом отношении показательна реакция K[C6F5BF3] с XeF2 в безводном HF, где параллельно с дифторированием ароматического кольца происходит замещение атома бора на ксенон [77].
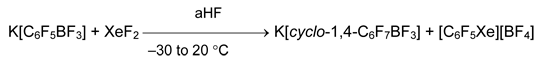
Детальный анализ современного состояния химии ксенонорганических соединений и тенденции её развития см. в обзорах [60, 61].
Список литературы
Материал рекомендован к публикации членом редколлегии В.Е. Платоновым
Fluorine Notes, 2012, 80, 1-2
