Received: июль, 2011
Fluorine Notes, 2012, 80, 3-4
α-ГАЛОГЕНАЛКИЛОВЫЕ ЭФИРЫ И АЦЕТАЛИ НА ОСНОВЕ 1,1,5-ТРИГИДРОПЕРФТОРПЕНТАН-1-ОЛА
А. И. Рахимов, О. Н. Кутыга, А. В. Мирошниченко, Нгуен Тхи Бик Хань
Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
Аннотация. α-Хлор- и α- бромэфиры 1,1,5-тригидроперфторпетан-1-ола синтезированы реакцией H(CF2CF2)2CH2OH с этаналем, пропаналем и хлористым или бромистым водородом. α-Бромэфиры в отличие от α-хлорэфиров – нестойкие вещества, но обладают высокой реакционной способностью при низких температурах. α-Хлор-, α - бромэфиры образуют ацетали со спиртами и сложные эфиры с солями карбоновых кислот. Проведено сравнение возможности применения в органическом синтезе полифторированных α-хлор- и α- бромэфиров.
Ключевые слова: Полифторированный спирт. α-хлор- и α-бромэфиры 1,1,5-тригидроперфторпетан-1-ола, 1,1-ди(1',1',5'-тригидроперфторпентокси)этан, 1,1-ди(1', 1',5'-тригидроперфторпентокси)пропан.
Ранее [1-6] рассмотрены свойства полифторированных спиртов, синтез и свойства α-хлорэфиров, включая α-хлорполифторалкиловые эфиры.
В данной работе на примере 1,1,5-тригидроперфторпентан-1-ола проведено сравнение свойств и возможностей применения в органическом синтезе α-хлор- и α- бромполифторалкиловых эфиров.
При синтезе α-хлор-, α-бромполифторалкиловых эфиров применяли растворы в сухом хлороформе 1,1,5-тригидроперфторпентанола и уксусного или пропионового альдегидов (брали эквимолярные соотношения реагентов).
Смешение указанных реагентов проводили при получении α-хлорэфира при температуре -5 °С добавлением к раствору 1,1,5-тригидроперфторпентанола охлажденного раствора уксусного альдегида в хлороформе и пропускании через указанную смесь десятикратного избытка сухого хлористого водорода в течение 2–2.5 ч. Реакция идет по схеме:
CH3CHO + HCI → CH3CH(CI)OH
CH3CH(CI)OH+
H(CF2CF2)2CH2OH →CH3CH(CI)OCH2(CF2CF2)2 H+H2O
После окончания реакции избыточное количество хлористого водорода отдували током инертного газа (азот или воздух). Водный слой отделяли, органический – сушили сернокислым магнием. После удаления растворителя при уменьшенном давлении остаток перегоняли в вакууме. Выход α-хлорэфира составляет 69%.
Механизм реакции, наиболее вероятно, включает взаимодействие ассоциатов (I) полифторированного спирта и альдегида с хлористым водородом с образованием шестичленного переходного состояния (II), трансформирующегося в полуацеталь (III), который далее реагирует с хлористым водородом с получением α-хлорполифторалкилового эфира:
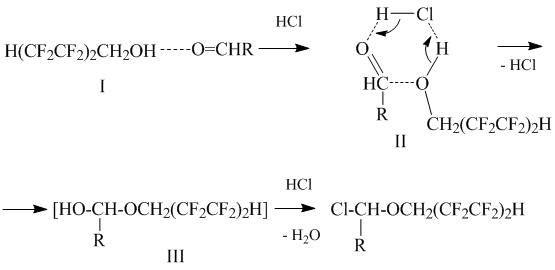
Образование промежуточного полуацеталя (III) было доказано методом меченых атомов: молекула реакционной воды содержит изотоп атома кислорода, введенный в исходный альдегид [6].
1-Хлор-1-(1',1',5'-тригидроперфторпентокси)этан получен с выходом 69%. Это бесцветная легко перегоняющаяся жидкость с т.кип. 52–53 °С при 15 мм рт. ст. Строение α-хлорполифторалкилового эфира подтверждено ПМР- и ИК-спектрами. В ПМР-спектрах H(CF2CF2)2CH2-группа идентифицируется двумя характерными сигналами протонов HCF2-группы и CF2CH2-группы [7]. Протон HCF2-группы в результате ближнего и дальнего взаимодействий с атомами фтора проявляется в виде симметричного триплета триплетов с положением δ = 5.72 м. д. для центрального сигнала центрального триплета. Значение констант спин-спинового взаимодействия составляют JH-F = 51.0 Гц и для JHC-CF = 5.2 Гц. Группа -СН2- образует спектр типа ABX2 (X=F) с δА = 4.10 м. д., δB = 3.90 м. д.. Сигнал группы -СН- представлен в виде квадруплета в области δ = 5.52–5.36 м. д. JН-H = 6.0 Гц. Протонам СН3-группы соответствует дублет в сильном поле с δ = 1.70 м. д. и δ = 1.60 м. д.
Полученный α-хлорэфир был использован в реакции с 1,1,5-тригидроперфторпентанолом. При этом получен ацеталь – 1,1-ди(1',1',5'-тригидроперфторпентоксиэтан. Реакция проведена в сухом гексане при 30 °С в течении 3 ч. с удалением выделяющегося хлористого водорода током сухого азота. Реакция идет по схеме:
СН3СН(CI)ОСН2(CF2CF2)2H + H(CF2CF2)2СН2ОH → HCI + СН3СН[ОСН2(CF2CF2)2H]2
Выход ацеталя составляет 51%. Ацеталь представляет собой бесцветную высококипящую жидкость (т. кип. 91–92 °С при 2 мм рт. ст.). Строение ацеталя подтверждено ПМР- и ИК-спектрами. В ПМР-спектрах HCF2CF2-группа проявляется в виде симметричного триплета триплетов с близкими значениями констант, соответствующие HCF2CF2-группе в α-хлорполифторалкиловом эфире, которые составляют δHCF2= 5.74 м. д. и JH-C = 53 Гц, JHC-CF = 4.4 Гц. Протоны СН2-О-группы дают триплет с центром 3.65 м. д. и JHC-CF = 14 Гц. Протоны для алкильных групп легко идентифицируются по положению их сигнала и характеру спин-спинового взаимодействия.
α-Бромэфир 1,1,5-тригидроперфторпентанола был получен на примере пропионового альдегида. Реакцию проводили в потоке сжатого воздуха сухого бромистого водорода подачей в охлажденный до температуры –12 ÷ –14 °С хлороформный раствор 1,1,5-тригидроперфторпентанола и пропионового альдегида, содержащий свежепрокаленный сульфат натрия в качестве осушителя. Реакция проходит аналогично рассмотренному ранее получению α-хлорэфира по схеме:
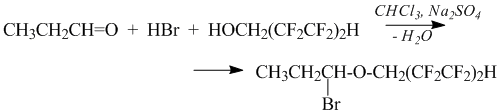
За участием бромистого водорода в реакции удобно наблюдать по изменению окраски: после насыщения раствора бромистым водородом реакционная масса приобретает желтоватую окраску, которая исчезает после плавного подъема температуры реакционной массы до 25°С и выдержки ее при указанной температуре в течение 1-2 часов. Однако, при увеличении времени выдержки и температуры реакционная смесь приобретает темный цвет, указывающий на процессы разложения α-бромэфира.
Высокая реакционная способность α-бромэфира при низких температурах (-12÷-14 °С) была использована для замещения брома на полифторалкокси– заместитель при синтезе ацеталя в условиях избытка полифторированного спирта. Реакция нуклеофильного замещения идет по схеме:
СН3СН2СН(Br)ОСН2(CF2CF2)2H + H(CF2CF2)2СН2ОH → HBr + СН3СН2СН[ОСН2(CF2CF2)2H]2
Завершающую стадию реакции проводили при температуре не превышающей 20-25°С. Выход 1,1-ди(1,1,5-тригидроперфторпентокси)-пропана составляет 58.3%. Полученный ацеталь представляет собой прозрачную бесцветную жидкость (т. кип. 76 °С при 1 мм. рт. ст.).
В ИК-спектре ацеталя для системы связей С-О-С-О-С характерна интенсивная полоса при 1318 см-1. В области 1126 см-1 проявляются НСF2 группы. Характерные полосы поглощения метильной, метиленовой и метиновой групп проявляются в областях 3010, 2980, 2920 см-1 в виде сильных полос.
ПМР-спектр ацеталя характеризуется наличием триплета триплетов с 5.77 м.д., соответствующего протону группы HСF2СF2. Расщепление в триплете обусловлено спин-спиновым взаимодействием протона с атомами фтора группы HСF2СF2 : JH-C= 53 Гц и JHC-CF= 4.4 Гц. Интенсивный триплет в области 3.9 м.д. относится к протонам метиленовой группы –О-CH2-CF2, а его мультиплетность обусловлена взаимодействием протонов с атомами фтора с JHC-CF= 14 Гц. Группа СН3СН2СН проявляется в виде триплета в области 4.6 м.д., который соответствует протону СН- группы. Мультиплет в области 1.6 м.д. и триплет в области 0.9 м.д. характеризуют протоны метиленовой и метильной групп соответственно.
Замещение галогена в α-хлор- и α-бромэфирах 1,1,5-тригидроперфторпетан-1-ола на сложноэфирную группу протекает в мягких условиях.
α-Бромэфир реагирует с ацетатом натрия в условиях его образования (стадия выделения эфира при этом исключена) при температуре -8÷ -11°С. Выход 1-(1',1',5'-тригидроперфторпентокси)-1-ацетокси-пропана составляет 65 % (прозрачная бесцветная жидкость с т. кип. 64 °С при 1 мм рт. ст.). Реакция идет по схеме:
СН3СН2СН(Br)ОСН2(CF2CF2)2H + CH3COONa → NaCI + СН3СН2СН(OC(O)CH3)ОСН2(CF2CF2)2H
В ИК-спектре 1-(1',1',5'-тригидроперфторпентокси)-1-ацетоксипроана присутствует характерная интенсивная узкая полоса поглощения при 1804 см-1, характерная для валентных колебаний νС=О сложноэфирной группы, содержащей электроноакцепторный полифторалкильный заместитель. В области 1138 см-1 проявляются поглощение СF2 группы. Поглощение в области 3010, 2974, 2920 см-1 обусловлено валентными колебаниями С-Н.
ПМР-спектр имеет характерный для рассмотренной ранее группы HСF2СF2 триплет триплетов в области 5.82 м.д.. Аналогичен также интенсивный триплет в области 3.9 м.д., принадлежащий протонам метиленовой группы -О-CH2-CF2.
В области 4.76 м.д. проявляется триплет, который соответствует протону метиновой группы, триплет в области 0.90 м.д. и синглет в области 1.50 м.д. указывают на наличие протонов метиленовой и метильной групп.
Было установлено, что α-хлорэфир в отличие от α-бромэфира реагирует с солями карбоновых кислот в более жестких условиях. На примере реакции 1-хлор-1-(1',1',5'-тригидроперфторпентокси)этана с акрилатом натрия показано, что замещение хлора на акрилатную группу протекает при температуре 40 °С с образованием 1-(1',1',5'-тригидроперфторпентокси)-1-акрилоксиэтана:
СН3СН(CI)ОСН2(CF2CF2)2H + СН2=CHCOONa → NaCI + СН3СН(OC(O)CH=СН2)ОСН2(CF2CF2)2H
Полученный с выходом 80% мономер представляет собой бесцветную жидкость с т. кип. 79-80 °С при вакууме 5 мм рт. ст. Этот мономер может использоваться для модификации полимерных композиций в направлении повышения износо-, термо-, светостойкости получаемых материалов и для придания им гидрофобных свойств.
Экспериментальная часть
Строение полученных веществ доказано ИК- и ПМР-спектроскопией. ИК-спектры полученных веществ снимали на приборе "Spekord – M82", в тонком слое (жидкая пленка) и в растворе хлороформа. ПМР-спектры веществ снимались на приборе Mercury-300 (Varian), рабочая частота 300 МГц, внутренний стандарт тетраметилсилан.
Синтез 1-хлор-1-(1',1',5'-тригидроперфторпентокси)этана.
К раствору 0.20 моль 1,1,5-тригидроперфторпропентанола
в 50 мл сухого хлороформа, охлажденному до -5 °С, добавляли 0.20 моль уксусного альдегида
в 20 мл хлороформа. Через реакционную смесь пропускали 1.5–2 моль сухого хлористого водорода
в течение 2–2.5 ч, поддерживая температуру -5÷ +5 °С. После окончания реакции избыточное
количество хлористого водорода отдували током сухого инертного газа (азота). Водный слой
отделяли, органический – сушили сернокислым магнием. После удаления растворителя при уменьшенном
давлении остаток перегоняли в вакууме. Выход α-хлорэфира 69% (т. кип. 52–53 °С при 15
мм рт. ст., nD20 1.3460, d420 1.4925).
Найдено, %: С 28.49; Н 2.35; Cl 11.98; F 48.00. C7H8OF4Cl.
Вычислено, %: С28.52; Н 2.38; Cl 12.0. F 51.61.
Синтез 1,1-ди(1',1',5'-тригидроперфторпентокси)этана.
К раствору 0.05 моль 1-хлор-1-(1',1',5'-тригидроперфторпентокси)этана в 50 мл
сухого гексана, охлажденному до 0 °С добавляли по каплям 0.05 моль 1,1,5-тригидроперфторпентанола
в 20 мл сухого гексана. Через реакционную смесь пропускали ток сухого азота для удаления
выделяющегося хлористого водорода. Постепенно поднимали температуру до 30 °С и перемешивали
реакционную смесь в течение 3 ч. После удаления растворителя остаток перегоняли в вакууме.
Выход 51% . Т. кип. 91–92 °С при 2 мм рт. ст., nD20 1.3331,
d420 1.6011. Найдено, %: С 29.32; Н 2.01; F 60.71. C12H10O2F16.
Вычислено, %: С 29.32; Н 2.04; F 62.04.
Синтез 1-(1',1',5'-тригидроперфторпентокси)-1-ацетокси-пропана
.В реактор помещали 0.106 моль сульфата натрия, 90 мл хлороформа и смесь 0.106 моль 1,1,5-тригидроперфторпентанола
с 0.106 моль пропионового альдегида. Реакционную массу охлаждали до –12 °С. Затем в воздушном
потоке вводили 0.106 моль НBr (определяли по привесу). После окончания подачи бромистого
водорода реакционная масса приобретает светло-желтый цвет. Реакционную смесь выдерживали
при температуре –12 ÷ –14 °С в течение 3 ч. Затем добавляли 0.106 моль ацетата натрия – реакционная
смесь становилась бесцветной. Смесь перемешивали еще 2 ч. при температуре –11 ÷ –8 °С. После
этого реакционную массу отфильтровывали от сульфата натрия и бромида натрия, хлороформ удаляли.
Остаток перегоняли под вакуумом. Выход 65%. 1-(1',1',5'-Тригидроперфторпентокси)-1-ацетокси-пропан
– прозрачная бесцветная жидкость, с т. кип. 64 °С при 1 мм рт. ст., nD20 1.3745. Найдено, %: F 45.19. C10H12O3F8.Вычислено,
%: F 45.78.
Синтез 1-(1',1',5'-тригидроперфторпентокси)-1-акрилоксиэтана.
В 40 мл сухого
фреона-113 добавляли 0.05 моль 1-хлор-1-(1',1',5'-тригидроперфторпентокси)этана,
а затем при перемешивании вводили 0.06 моль акрилата натрия и повышали температуру до 40
°С. Через 6 ч. перемешивания реакционной смеси удаляли осадок, фильтрат промывали 5%-ным
раствором бикарбоната натрия, водой до нейтральной реакции, сушили сульфатом магния. После
удаления растворителя остаток перегоняли в вакууме. Выход акрилата 80% . Т. кип. 79–80 °С
при 5 мм. рт. ст., nD20 1.3620, d420 1.4236. Найдено, %: С 36.29; Н 3.03; F 44.24. C10H10O3F8.
Вычислено, %: С 36.36; Н 3.03; F 46.06.
Библиографический список
- Рахимов, А. И. ЖОХ / А. И. Рахимов, О.Н. Кутыга, А.А. Бакшаева - 2009. Т.79. Вып. 11. С. 1026 .
- Ловлейс, Л. Алифатические фторсодержащие соединения / Л. Ловлейс, Д. Роуч, У.Постельнек - М.: ИЛ, 1961. 345 с.
- Кролевец, А. А. // Химия алифатических фторорганических спиртов. Итоги науки и техники. Серия Органическая химия. М. 1985. Т. 6. С. 144-154.
- Сторожакова, Н. А. Химия и технология элементорганических мономеров и полимерных материалов. Сб. науч. тр. ВолгГТУ. / Н. А. Сторожакова, В. Ф. Желтобрюхов - Волгоград. 1999. С.105-111.
- Рахимов, А. И. Изв. ВолгГТУ. Серия "Химия и технология элементорганических мономеров и полимерных материалов". Межвуз. сб. науч. ст. / А. И. Рахимов, А. В. Налесная, О. В. Вострикова, Н. А. Сторожакова - ВолгГТУ. Волгоград. 2004. Вып. 1. N 2. С. 39-41.
- Поконова, Ю. В. Галоидэфиры. Способы получения, свойства, применение - М.: Химия, 1966. 339 с.
- Ионин, Б. И. ЯМР-спектроскопия в органической химии / Б. И. Ионин, Б.А. Ершов, А. И. Кольцов - Л.: Химия, 1983. 269 с.
Материал рекомендован к публикации членом редколлегии А.И. Рахимовым
Fluorine Notes, 2012, 80, 3-4
