Fluorine Notes, 2011, 79, 1-2
Электрофильные реакции, карбокатионы и катионоидные скелетные превращения в ряду полифтораренов
В.М.Карпов, Т.В.Меженкова, В.Е.Платонов
Учреждение Российской академии наук Новосибирский институт органической химии им. Н.Н.Ворожцова Сибирского
отделения РАН, 630090, Новосибирск, пр. Лаврентьева, 9; телефон (383)3306943
e-mail: karpov@nioch.nsc.ru
Аннотация.РОбобщены данные о генерировании и свойствах полифторированных аренониевых, бензильных, инденильных и флуоренильных катионов. Рассмотрены закономерности катионоидных скелетных превращений полифторированных бензоциклоалкенов и их карбонильных производных, протекающих с сокращением, расширением и раскрытием алициклического фрагмента субстрата.
Ключевые слова: полифторарены, бензоциклоалкены, электрофильные реакции, карбокатионы, катионоидные скелетные превращения.
Углеродный остов полифторароматических соединений, обедненный электронами за счет сильного индуктивного эффекта атомов фтора, дезактивирован по отношению к атаке электрофильными реагентами. В то же время благодаря наличию неподеленных пар атомы фтора могут участвовать в стабилизации образующихся карбокатионов по механизму p, π-сопряжения.
Для неполностью фторированных ароматических соединений возможность электрофильного замещения атома водорода впервые была показана на примере нитрования 1,2,3,5-тетрафторбензола [1], а также иодирования, бромирования и сульфирования пентафторбензола [2,3]. Превращения перфтораренов, обусловленные неизвестной для ароматических соединений ipso-атакой электрофила по положению, занятому атомом фтора, были обнаружены на примере присоединения реагентов нитрования к октафторнафталину [4,5] (Схема 1).
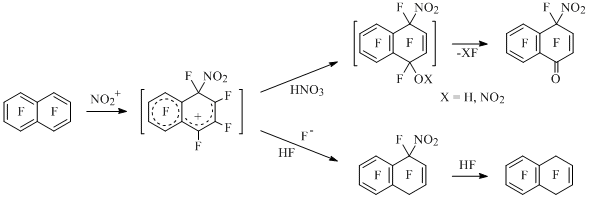
Схема 1
Реакции различных полифтораренов с нитрующими агентами были систематически изучены и наряду с другими данными по взаимодействию полифторароматических соединений с электрофилами обобщены в обзоре [6] и монографии [7].
При этом аренониевые ионы, отвечающие присоединению катиона нитрония к полифторарену и содержащие в sp3-гибридном узле одновременно атом фтора и нитро-группу, зафиксировать в реакции или генерировать каким-либо иным путем не удалось [7,8]. В то же время подобные катионы с CFCl-геминальным узлом генерированы, в том числе при электрофильном хлорировании полифторбензолов и полифторнафталинов при низкой температуре в системе Cl2-SbF5-SO2ClF [9-11] (Схема 2), например:
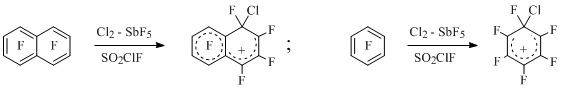
Схема 2
Кроме того, при хлорировании 1-Н-гептафторнафталина зафиксирован редкий случай образования нафталинониевого иона, являющегося интермедиатом при замещении атома водорода и дающего при обработке метанолом 1-хлоргептафторнафталин [11] (Схема 3).
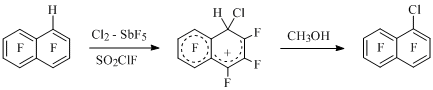
Схема 3
Первые же перфторированные аренониевые ионы были генерированы путем отрыва аниона фтора из перфтордигидроароматических соединений с помощью пятифтористой сурьмы [12] (Схема 4).
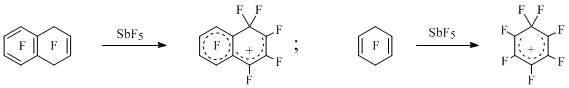
Схема 4
Этим методом наряду с электрофильным галогенированием и метилированием (CH3F-SbF5) полифтораренов, а также протонированием (HSO3F-SbF5) полифторциклогексадиенонов генерирован большой ряд стабильных полифторированных бензолониевых, нафталинониевых и антраценониевых ионов, содержащих заместители в различных положениях. Обобщенные данные по строению этих катионов, их электронной структуре, относительной стабильности и химическим свойствам проанализированы в обзоре [8] и монографии [7]. При этом следует отметить неожиданный факт образования метилгептафторнафталинов (выход 40-50%) при метилировании октафторнафталина [13] (Схема 5).
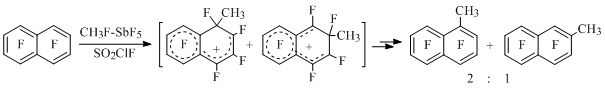
Схема 5
В результате отрыва аниона фтора, хлора или брома из положения 1 полифторинденов под действием избытка пятифтористой сурьмы в SO2 или SO2ClF генерирован набор полифторированных инденильных катионов [14-19] (Схема 6), например:
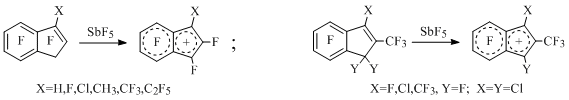
Схема 6
В π-системе углеродного остова полифторинденильных катионов, как и в π-системе антиароматического инденильного катиона [20-23], 4n (8) электронов. В соответствии с этим они должны быть отнесены к антиароматическим. Однако, в отличие от инденильного катиона, в его фторсодержащих аналогах взаимодействие р-электронов атомов фтора с π-системой углеродного остова иона, а также π-σ-взаимодействия усложняют картину. В связи с этим для рассмотрения вопроса об их степени (анти)ароматичности был привлечен критерий, используемый в работах Дьюара [20] и Бреслоу [21-23] и заключающийся в сравнении энергетических характеристик циклического и соответствующего ему "открытого" иона с разомкнутой π-системой, не являющихся изомерами. При этом нужно учитывать разное количество σ-связей, а также их степень сжатия в циклическом и открытом ионах [20] (Схема 7).

Схема 7
В работе [16] в рамках данного критерия было предложено использовать заряженные и незаряженные соединения, способные формально давать изомеры, как с циклической, так и с "открытой" цепью сопряжения (Схема 8), например:
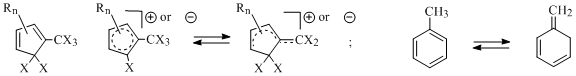
Схема 8
Использование таких моделей позволяет экспериментально напрямую изучать относительную стабильность циклических и "открытых" систем. С точки зрения квантово-химических расчетов, достоинством этих моделей является возможность непосредственно сравнивать полные энергии изомеров, не внося ошибку за счет присоединения дополнительных атомов для соединений с разомкнутой цепью сопряжения [24].
Оказалось, что в отличие от антиароматического инденильного катиона, относительная стабильность которого ниже стабильности его аналога с разомкнутой π-системой, генерированные в растворе перфторалкилинденильные катионы и полифторалкилинденильные катионы с атомами хлора в пятичленном цикле термодинамически более устойчивы, чем изомерные им алкилиденинданильные ионы, имеющие разомкнутую π-систему [16,19,25].
Так, из перфтор-2-метилиндена в системе SbF5-SO2 или SbF5 генерирован катион 1, который существует в интервале температур от –60 до +140°С. При выдерживании раствора соли этого катиона в пятифтористой сурьме при комнатной температуре более двух лет в спектре ЯМР 19F катиона не происходит никаких изменений. Наблюдаемая картина, по-видимому, связана с большей термодинамической стабильностью иона 1 по сравнению с катионом 2 [16] (Схема 9).
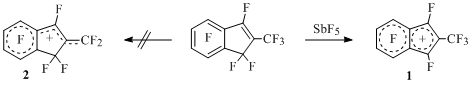
Схема 9
Из других пар изомерных ионов генерированы перфтор-1-алкилинденильные катионы 3 и 4 и их "открытые" аналоги 5и 6(E,Z-изомеры) и показано, что первые термодинамически устойчивее последних независимо от относительной стабильности нейтральных предшественников [19] (Схема 10).
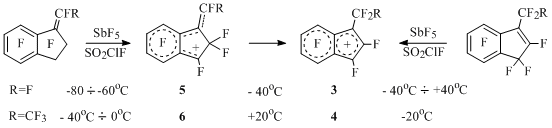
Схема 10
Большая термодинамическая стабильность циклических катионов по сравнению с их "открытыми" изомерами наблюдается также в случае хлор- и дихлорперфторметилинденильных катионов. Так, из E,Z-изомеров 1-(фторхлорметилен)октафториндана и 3-хлорперфтор-1-метилениндана под действием пятифтористой сурьмы при низкой температуре генерированы соответствующие метиленинданильные катионы, которые при 0°С изомеризуются в 3-хлорперфтор-1-метилинденильный катион (7) [25] (Схема 11).
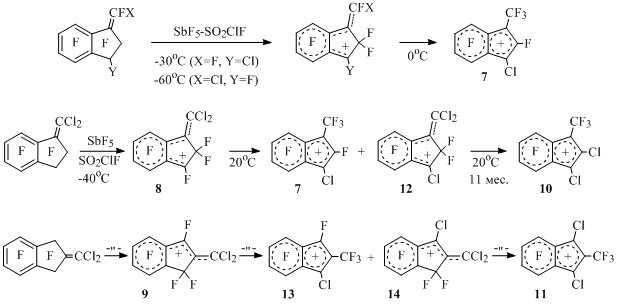
Схема 11
Аналогичным образом из 1- и 2-дихлорметиленоктафторинданов генерированы катионы 8 и 9, которые при комнатной температуре постепенно превращаются в дихлорперфторметилинденильные катионы 10 и 11через промежуточное образование инденильных (7 и 13)и метиленинданильных (12 и 14)катионов [25] (Схема 11).
Большая термодинамическая стабильность полифторинденильных катионов по сравнению с их изомерами с разомкнутой π-системой, дала повод усомниться в антиароматической природе таких катионов и высказать предположение об их ароматическом характере [16,19]. При этом не исключалось, что в некоторых других случаях введение заместителей с сильным +М или –М эффектом в молекулу антиароматического соединения позволит “превратить“ это соединение в ароматическое или, по крайне мере, снизить его степень антиароматичности.
Этому не противоречат и результаты квантово-химического исследования фторсодержащих циклопентадиенильных, инденильных и β-нафтинденильных катионов [24]. Методом MNDO проведена оценка их степени (анти)ароматичности в рамках критерия Дьюара-Бреслоу с использованием в качестве индекса ароматичности разности энтальпий образования изомерных катионов с циклической и разомкнутой π-системой: Δ=ΔHf(cycl.)-ΔHf(open). Оказалось, что степень ароматичности существенно зависит как от углеродного скелета, так и от наличия и расположения в нем атомов фтора. При этом для метилциклопентадиенильных катионов величина Δ всегда положительна (катионы антиароматические), а для метилинденильных и метил-β-нафтинденильных катионов под влиянием атомов фтора возможна перемена знака, т.е. циклическая π-система может становиться энергетически выгоднее разомкнутой [24] (Схема 12), например:
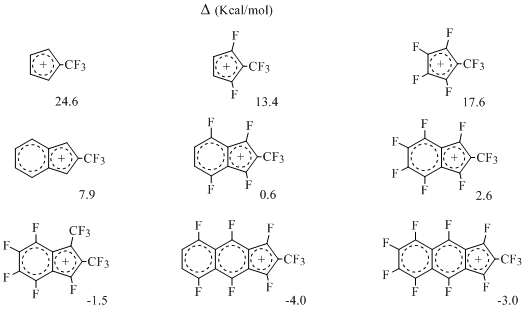
Схема 12
Обнаружена линейная корреляционная зависимость между индексом ароматичности Дьюара-Бреслоу (Δ) и энергией низшего синглет-синглетного возбуждения для катионов с циклической π-системой. Включение в статистическую обработку аналогичных точек для ароматических толуола и метилциклопентадиенильного аниона привела к линейной зависимости с близкими параметрами, но с более высоким коэффициентом корреляции. Существование такой зависимости позволяет рассматривать величину энергии низшего синглет-синглетного возбуждения в соединениях с циклической π-системой как универсальную характеристику их степени ароматичности, в том числе для циклических систем, не имеющих изомеров с разомкнутой цепью сопряжения [24].
Кроме полифторинденильных катионов генерированы стабильные перфторированные 9-метилфлуоренильный, флуоренильный и 9-фенилфлуоренильный катионы, содержащие в π-системе углеродного остова 4n (12) электронов. Раствор соли первого катиона получен путем отрыва аниона фтора из соответствующего флуорена с помощью пятифтористой сурьмы [26] (Схема 13).
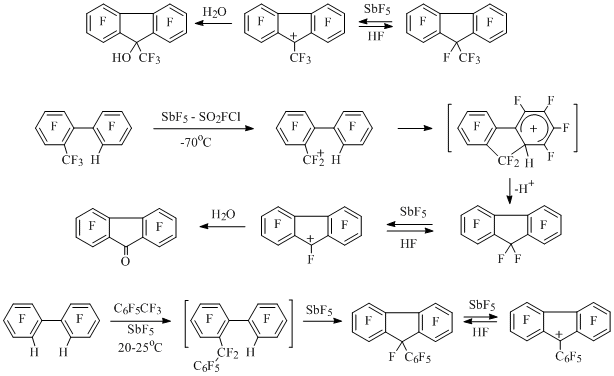
Схема 13
В двух последних случаях флуореновый скелет сформирован в результате электрофильного алкилирования производных бифенила. Так при растворении 2-трифторметил-2'-Н-октафторбифенила в SbF5-SO2ClF при низкой температуре генерируется бифенилметильный катион, который подвергается внутримолекулярной циклизации с образованием перфторфлуорена и затем перфторфлуоренильного катиона [27]. При взаимодействии 2,2'-Н,Н-октафторбифенила с гептафторбензильным катионом, генерируемым из октафтортолуола в пятифтористой сурьме, происходит двуступенчатое алкилирование бифенила с образованием раствора соли перфтор-9-фенилфлуоренильного катиона, которая после обработки безводным фтористым водородом дает перфтор-9-фенилфлуорен [27] (Схема 13).
Ранее отрывом аниона фтора из пентафторфенилфторметана под действием пятифтористой сурьмы был генерирован пентафторфенилметильный катион [28] (Схема 14). Аналогичным образом из пентафторфенилдифторметана, октафтортолуола и 4-Х-гептафтортолуолов (X=H,F,Cl,Br,CH3) под действием SbF5 генерированы соответствующие бензильные катионы [29]. Последние взаимодействуют с тетрафторбензолами и пентафторбензолом в среде пятифтористой сурьмы с образованием дифенилметильных катионов, которые не реагируют с избытком полифторбензола [30] (Схема 14).
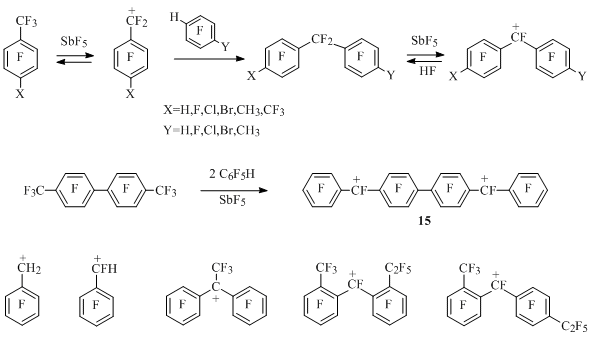
Схема 14
Раствор перфтор-п-ксилола в SbF5 не содержит перфтор-п-метилбензильного катиона в концентрации, достаточной для наблюдения методом ЯМР 19F [29], однако в небольшой концентрации он, по-видимому, получается, о чем может свидетельствовать образование диарилметильных катионов (X=CF3, Y=F, CH3) в реакции перфтор-п-ксилола с пентафторбензолом и 2,3,5,6-тетрафтортолуолом в среде SbF5 [30] (Схема 14).
Перфтор-4,4'-диметилбифенил в среде пятифтористой сурьмы также не дает в заметной концентрации моно- или ди-катионов, однако взаимодействует с двумя молями пентафторбензола, образуя дикатион 15 [30] (Схема 14).
Отрывом аниона фтора из соответствующих перфтордиарилметанов под действием пятифтористой сурьмы генерированы диарилметильные катионы, содержащие перфторалкильные группы у катионного центра [30] или в резонансных положениях обоих колец [31] (Схема 14).
К бензильным катионам могут быть отнесены также полифторбензоциклоалкен-1-ильные катионы. Так, из 1,1-дихлороктафториндана в пятифтористой сурьме или при нагревании перфториндана со смесью SbCl5-SbF5, взятых в молярном соотношении ~1:0.25:3, образуется 1-хлороктафториндан-1-ильный катион [32] (Схема 15). При растворении перфторбензоциклобутена в пятифтористой сурьме генерируется перфторбензоциклобутен-1-ильный катион [33,34]. Перфторированные индан и тетралин в аналогичных условиях не дают в заметной концентрации подобные ионы [34], однако они, как и бензоциклобутен, реагируют с пентафторбензолом, образуя перфтор-1-фенилбензоциклоалкен-1-ильные катионы [35] (Схема 15).
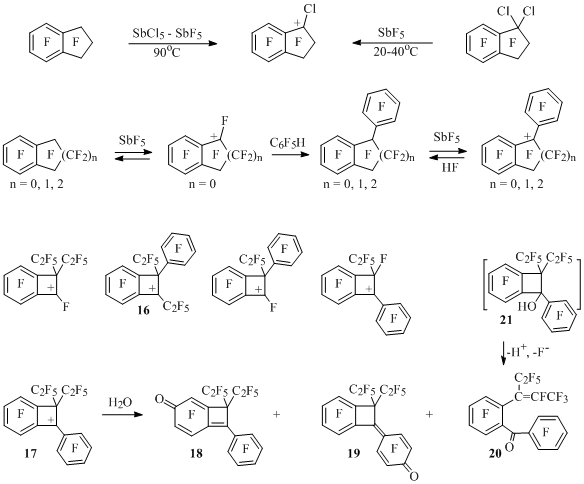
Схема 15
Кроме того, подобным образом генерированы полифторбензоциклобутен-1-ильные катионы [36], приведенные на схеме 15. При взаимодействии катиона 17 с водой образуются соединения 18-20, отвечающие присоединению воды не только к зарядовому центру (спирт 21), но и к другим атомам углерода, находящимся в резонансных положениях иона 17. Бензофенон 20, по-видимому образуется из спирта 21, в котором происходит раскрытие четырехчленного цикла по типу галоформного распада. Подобная картина наблюдается также в случае катиона 16 [36]. Перфторированные 1-фенил-2-метилбензоциклобутен [37], 1-фенил-3-этилиндан, 1,3-дифенил-3-этилиндан и 1-фенил-4-этилтетралин [38], образующиеся в реакции перфторалкилбензоциклоалкенов с пентафторбензолом в присутствии SbF5, в растворе пятифтористой сурьмы, по-видимому, также существуют в виде 1-фенилбензоциклоалкен-1-ильных катионов, поскольку при гидролизе растворов получаются соответствующие спирты или кетоны (Схема 16).
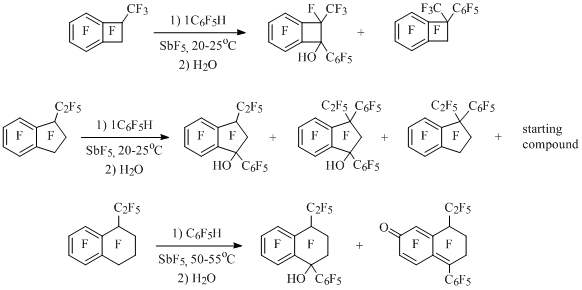
Схема 16
Взаимодействие с водой, приводящее к кислотам, карбонильным или гидрокси-производным, характерно для всех рассмотренных выше долгоживущих катионов (бензильных, инденильных, бензолониевых и т.д.). При этом наряду с гидролизом может происходить присоединение аниона фтора к катиону с образованием соответствующего перфторированного соединения. Так, например, при гидролизе раствора соли гептафторбензильного катиона, приготовленного из октафтортолуола и SbF5, взятых в молярном соотношении 1:5, пентафторбензойная кислота получается с выходом 48%. При этом возвращается 19% октафтортолуола [39] (Схема 17).
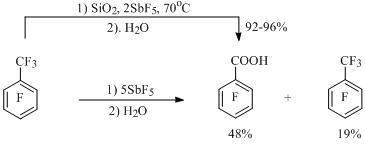
Схема 17
При проведении реакции октафтортолуола с SiO2/SbF5 пентафторбензойная кислота образуется с высоким выходом [40], причем с использованием меньшего количества пятифтористой сурьмы, чем в предыдущем случае (Схема 17). Этот метод позволяет синтезировать как моно-, так и дикарбонильные производные перфторированных алкилбензолов и бензоциклоалкенов, в том числе из тех, которые не дают катионы в заметных концентрациях [40-42] (Схема 18), например:
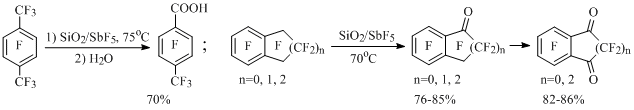
Схема 18
В реакции перфтор-1-этилиндана (R1 = F, R2 = C2F5) с SiO2/SbF5 соответствующий инданон образуется с невысоким выходом в смеси с другими соединениями [43]. Замена SiO2 на трифторуксусную кислоту как источник нуклеофильного кислорода позволяет проводить реакцию в более мягких условиях и получать карбонильные производные перфторированных алкилбензолов и бензоциклоалкенов с высоким выходом [44] (Схема 19), например:
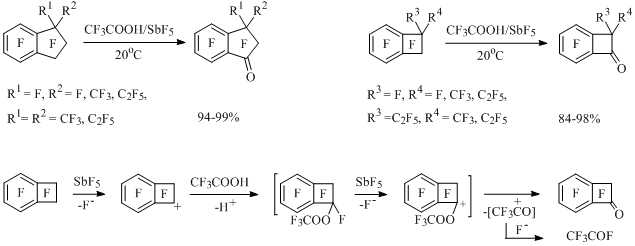
Схема 19
Реакционная способность перфторбензоциклоалкенов при взаимодействии с SiO2/SbF5 и с CF3COOH/SbF5 согласуется с относительной стабильностью бензоциклоалкен-1-ильных катионов и понижается при переходе от бензоциклобутена к индану и тетралину.
Полифторбензоциклоалкен-1-ильные катионы могут выступать в качестве алкилирующих агентов по отношению к фторолефинам. Так, перфтор-1-фенилбензоциклобутен-1-ильный катион реагирует с тетрафторэтиленом с образованием перфтор-1-фенил-1-этилбензоциклобутена [36]. В реакции перфторированных бензоциклобутена, индана и тетралина с тетрафторэтиленом в присутствии SbF5 получаются перфтор-1-этилбензоциклоалкены, которые далее превращаются в диэтилпроизводные. Реакционная способность бензоциклоалкена понижается с увеличением размера его алициклического фрагмента. При этом из тетралина образуется перфтор-1,4-диэтилтетралин, из бензоциклобутена – смесь перфтор-1,1- и -1,2-диэтилбензоциклобутенов примерно в равном соотношении, а из индана – только перфтор-1,1-диэтилиндан [34,45] (Схема 20).
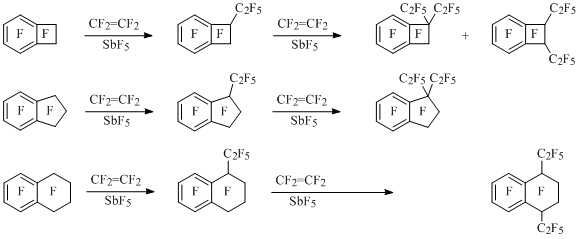
Схема 20
Из-за дестабилизирующего влияния перфторалкильной группы, находящейся у зарядового центра в бензоциклоалкенильных катионах B (Схема 21), следовало ожидать образования 1,2-, 1,3- и 1,4-диэтилпроизводных из бензоциклобутена, индана и тетралина с участием катионов А. Анализ электронных и стерических факторов, влияющих на реакционную способность и относительную стабильность карбокатионов А и B, позволил объяснить полученные результаты [34].
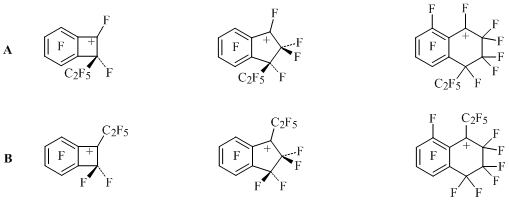
Схема 21
Подобные закономерности наблюдаются в катализируемой SbF5 реакции перфторбензоциклобутена с трифторхлорэтиленом и перфторпропиленом, перфтор-1-метилбензоциклобутена с тетрафторэтиленом и перфторпропиленом [33], а также перфторированных индана, бензоциклобутена и 1-метилбензоциклобутена с 1,2-дифтортордихлорэтиленом [46]. Дехлорированием продуктов взаимодействия полифторбензоциклоалкенов с дифтордихлорэтиленом синтезированы перфторвинилбензоциклоалкены [46].
В НИОХ обнаружены и изучаются неизвестные для перфторуглеродов катионоидные скелетные превращения перфторированных бензоциклоалкенов и их карбонильных производных. Так, при нагревании 2-бромгептафторнафталина с пятифтористой сурьмой до 300°С с одновременной отгонкой образующихся продуктов получается сложная смесь, содержащая 20-25% перфтор-1-метилиндана (22). Авторы полагают, что вначале происходит фторирование нафталина с образованием 2-бромперфтортетралина (23), из которого генерируется перфтортетралин-2-ильный катион (24), а в нем происходит сокращение шестичленного цикла до пятичленного [47] (Схема 22). В работе [48] показано, что из 2-бромтетралина 23, а также из 1,2- и 2,3-дибромдекафтортетралинов в аналогичных условиях образуется смесь, содержащая метилиндан 22.
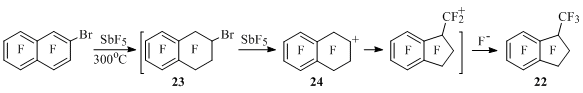
Схема 22
При переходе от бром- к хлорполифтортетралинам выход продуктов сокращения шестичленного кольца до пятичленного заметно возрастает. При этом в реакции 2-хлорполифтортетралинов 25, содержащих у одного sp3-гибридного атома углерода не более одного атома хлора, получаются индан 22 и хлориндан 26. Наряду с этим происходит частичный или полный обмен атомов хлора на фтор в исходном соединении 25. При накоплении атомов хлора в тетралине 25 выход индана 22 понижается с 63 до 22%, а хлориндана 26 возрастает с 8 до 19% (Схема 23).
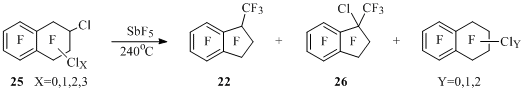
Схема 23
1,1,4,4-Тетрахлороктафтортетралин и перфтортетралин в аналогичных условиях не дают продуктов сокращения кольца [48], однако при длительном нагревании последнего с SbF5 (200°С, 34 ч) образуется индан 22 наряду с перфтор-2-изопропилтолуолом [49].
На примере взаимодействия 2-хлорперфтортетралина 27 с пятифтористой сурьмой предложен механизм сокращения шестичленного цикла в пятичленный, включающий генерацию тетралин-2-ильных катионов 24, 28, в которых катионный центр атакует ароматическое кольцо, а образующиеся аренониевые ионы 29 затем изомеризуются в инданилметильные катионы 30. Последние присоединяют анион фтора, давая инданы 22 и 26(Схема 24).
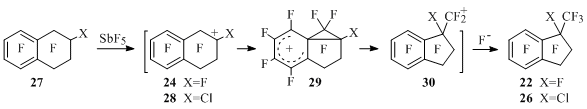
Схема 24
Отдельным экспериментом установлено, что продукт 26 под действием пятифтористой сурьмы частично превращается в индан 22[48]. Однако в работе [50] было показано, что и индан 22в условиях реакции может давать хлориндан 26. В связи с этим образование хлориндана 26 не может служить доводом в пользу обсуждаемого в работах [47,48] (Схемы 22, 24) механизма сокращения шестичленного кольца в пятичленное, согласно которому атом углерода, находящийся в α-положении тетралина, оказывается в трифторметильной группе образующегося индана (Схема 24).
Перфтор-1-этилтетралин (31) при нагревании с SbF5 изомеризуется в этилтетралин 32, в котором происходит сокращение шестичленного кольца до пятичленного с образованием метилэтилиндана 33. Последний при более высокой температуре превращается в триметилиндан 34. Аналогичным образом перфтор-1,4-диэтилтетралин (35) под действием SbF5 изомеризуется в диэтилтетралин 36, затем в нем происходитсокращение шестичленного алициклического фрагмента до пяти- и даже до четырехчленного с образованием изомерных триалкилиндана 37 и тетраалкилбензоциклобутена 38 [50,51] (Схема 25).
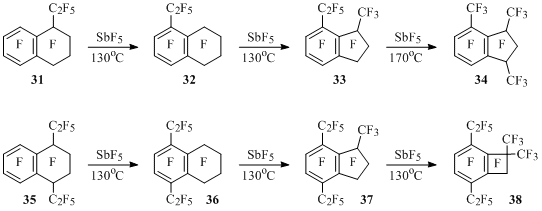
Схема 25
Сокращение алициклического фрагмента в тетралинах 32 и 36при наличии в них электроноакцепторных групп C2F5 неожиданно протекает легче (130°С) по сравнению с перфтортетралином (200°С), что не может быть объяснено в рамках схемы 24, поскольку хорошо известно, что перфторалкильные группы в ароматическом ядре субстрата затрудняют его реакции с электрофильными агентами.
Кроме того, в случае тетралина 32 в соответствии со схемой 24 следовало ожидать образования не продукта 33, а индана 33а, поскольку аренониевый ион 39, приводящий к соединению 33, должен быть менее устойчивым [группа C2F5 расположена в резонансном (*) положении], чем ион 39а, тогда как стабильность тетралинильных катионов 40 и 40а сравнима (Схема 26) [50].
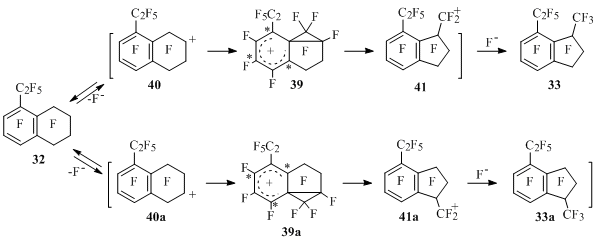
Схема 26
В связи с этим в работе [50] предложен другой путь протекания реакции – сокращение кольца в промежуточных тетралин-1-ильных катионах. Предполагается, что лимитирующей стадией процесса в случае тетралина 32 будет изомеризация тетралин-1-ильных катионов 42и 42ав инданилметильные ионы 41и 41а, например, путем 1,2-сдвига перфторалкильного фрагмента через переходное состояние 43и 43асоответственно (Схема 27).
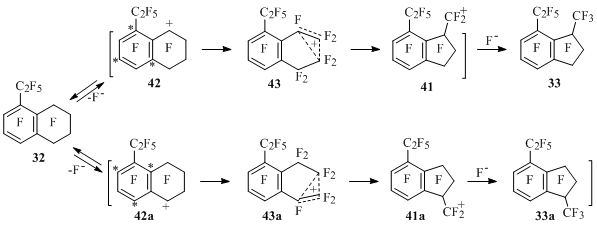
Схема 27
Из анализа относительной стабильности промежуточных катионов 41, 41а, 42и 42а следует, что из тетралина 32 преимущественно должен получаться (и получается) индан 33, а не его изомер 33а. Действительно, энергия катиона 42 выше по сравнению с ионом 42а, поскольку в нем группа C2F5 расположена в резонансном положении. В то же время инданилметильные ионы 41и 41а по энергии должны отличаться друг от друга значительно меньше. Следовательно, энергетический барьер для превращения катиона 42 в 41, по-видимому, будет ниже, чем для изомеризации катиона 42а в 41а. Аналогично объясняется и меньшая реакционная способность перфтортетралина по сравнению с 2-галогенполифтортетралинами, а также с этил- и диэтилтетралинами 32и 36[50].
Рассмотренный путь протекания процесса согласуется с тем фактом, что при электрофильном хлорировании 2-метилнафталина получается перхлор-3-винилинден [52] (Схема 28), а при хлорировании нафталина-(1-14С) элиминируется атом углерода, находящийся в положении 2 нафталина, с образованием CCl4 и перхлорированных индана и индена [53].
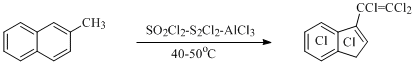
Схема 28
Возможный механизм изомеризации индана 33 в 34и путь сокращения пятичленного кольца до четырехчленного в индане 37 с образоваением соединения 38представлены на Схеме 29 [50]. Из соединений 33 и 37, по-видимому, генерируются катионы 44, в которых происходит раскрытие пятичленного кольца с образованием катионов 45. Внутримолекулярная циклизация иона 46, получающегося из катиона 45а, и последующее присоединение аниона фтора к иону 47 дает соединение 34.
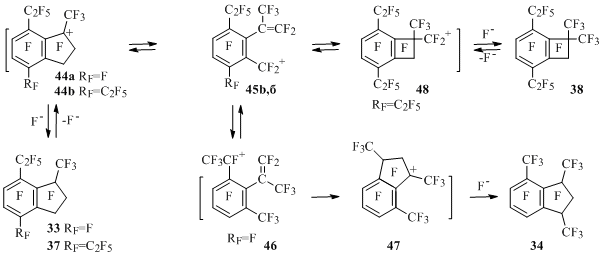
Схема 29
Внутримолекулярная атака одного или другого винильного атома углерода карбокатионным центром в ионе 45b будет приводить после присоединения аниона фтора к бензоциклобутену 38 или к исходному индану 37.
Скелетные превращения других полифторинданов также протекают через раскрытие пятичленного цикла в индан-1-ильных катионах с промежуточным образованием полифторстиролов, которые замыкаются внутримолекулярно с образованием новых инданов или фторируются, давая перфтор-1,2-диалкилбензолы. Так, из перфторированных индана, 1-метил-, 4- и 5-метилинданов при нагревании с пятифтористой сурьмой образуются перфтор-1,2-диалкилбензолы, а в перфтор-2-метилиндане происходит фторирование ароматического кольца [49] (Схема 30).
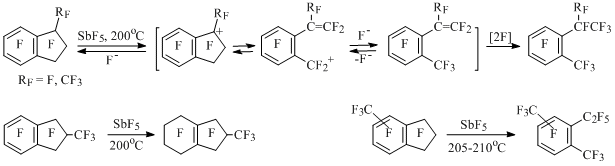
Схема 30
В реакциях перфтор-1-изопропилиндана (49) и перфтор-1-этилиндана (50) с SbF5 образование полифторстиролов зафиксировано. Так, изопропилиндан 49 под действием пятифтористой сурьмы при 90°С изомеризуется в тетраметилстирол 51. Последний в более жестких условиях циклизуется в триметилиндан 52, который далее теряет CF4, давая диметилинден 53. В отсутствие SbF5 соединения 49, 51, 52 при 130°С не изменяются [54] (Схема 31).
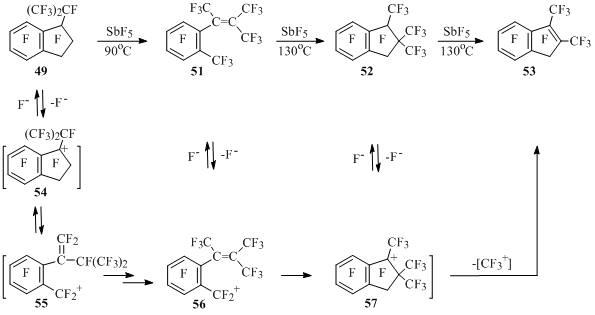
Схема 31
Предполагается, что из индана 49 под действием SbF5 генерируется катион 54, который изомеризуется в бензильный ион 55. В последнем происходит перемещение кратной связи внутрь цепи с образованием в конечном счете стирола 51. Внутримолекулярная циклизация иона 56, генерируемого из стирола 51, приводит к триметилинданильному катиону 57, из которого при присоединении аниона фтора получается индан 52, а при элиминировании CF3+ – инден 53 [54] (Схема 31).
При взаимодействии этилиндана 50 с пятифтористой сурьмой образуются продукты, приведенные на Схеме 32, соотношение их зависит от условий реакции. Показано, что соединения 53, 58, 60-63 не получаются издиметилиндана 59, равно как и сам индан 59 не образуется из этих соединений в среде пятифтористой сурьмы.
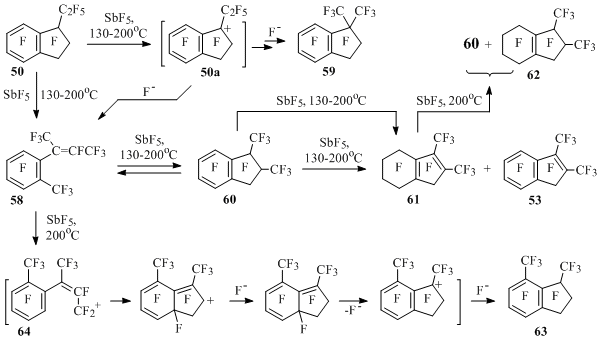
Схема 32
Стирол 58 и индан 60 превращаются друг в друга в присутствии SbF5. Индан 60 наряду с диспропорционированием на инден 53 и диен 61 фторируется до диена 61 и далее до продукта 62. В жестких условиях из соединений 58 и 60 образуется индан 63, который получается также из диена 61, поскольку последний в жестких условиях может диспропорционировать на соединения 60 и 62[55] (Схема 32).
Изомеризация этилиндана 50 в диметилиндан 59 и стирол 58, по-видимому, происходит с участием перфтор-1-этилиндан-1-ильного катиона (50а), в котором, с одной стороны, происходит 1,2-сдвиг трифторметильной группы с образованием после присоединения фторид-иона индана 59, а с другой – раскрытие пятичленного цикла с образованием в конечном итоге стирола 58. Индан 63 получается при высокой температуре, вероятно, в результате внутримолекулярной атаки ароматического кольца в генерируемом из стирола 58 катионе 64 [55] (Схема 32).
Подобное замыкание пропенильного фрагмента на ароматическое кольцо происходит при взаимодействии перфторированных 1- и 3-фенилпропенов с хлористым алюминием, приводящее к 1,1,3,3-тетрахлоргексафториндану и 1,1,3,3,5-пентахлорпентафториндану [56].
При наличии в индане циклопропанового кольца, конденсированного с пятичленным циклом, раскрытию под действием SbF5 подвергается циклопропановый фрагмент с образованием перфтор-1,1-диметилиндена или генерацией перфтор-1-метилинденильного катиона [57] (Схема 33).
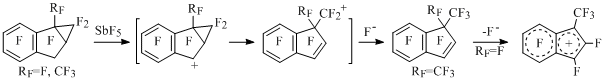
Схема 33
Раскрытие трехчленного цикла происходит также в перфторированных алкилциклопропанах под действием SbF5 [58] и хлорфторидов алюминия [59] с образованием перфторолефинов.
В реакции перфтор-1-метилбензоциклобутена с AlCl3 и AlBr3 наряду с обменом атомов фтора на галоген происходит расширение четырехчленного цикла до пятичленного, приводящее к 1,1,3,3-тетрагалогенполифторинданам [60,61]. При взаимодействии перфторированных 1-метил- (95°С) [60,61] и 1-этилбензоциклобутенов (130°С) [61] с пятифтористой сурьмой образуются перфторированные индан и 2-метилиндан. На примере перфтор-1-этилбензоциклобутена показано, что реакция протекает по пути 1 (Схема 34) [61].
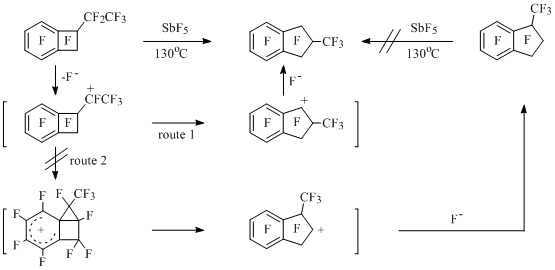
Схема 34
В отличие от этого, в нефторированном ряду расширение четырехчленного цикла осуществляется по пути 2. Данный вывод сделан на основании результатов, полученных при изучении ацетолиза тозилатов 1-(гидроксидидейтерометил)бензоциклобутена [62].
Реакция перфтор-1-изопропилбензоциклобутена с SbF5 протекает при 170°С, по-видимому, с участием замещенных изопропильного и бензоциклобутенильного катионов по двум направлениям с образованием продуктов расширения и раскрытия четырехчленного цикла [54] (Схема35).
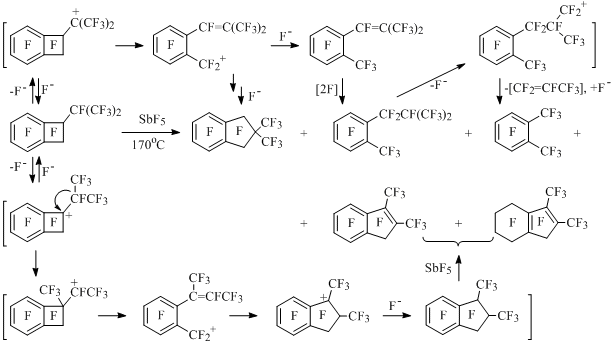
Схема 35
Перестройка углеродного скелета в перфторированных 1-метил-1-изопропил- и 1-метил-2-изопропилбензоциклобутенах под действием пятифтористой сурьмы происходит с участием более стабильного метильного катиона, причем в 1,1-изомере она протекает легче, чем в 1,2-изомере [54] (Схема 36).
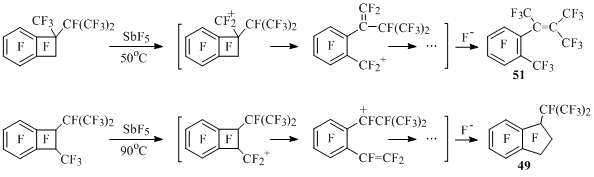
Схема 36
Соединения 49 и 51 в более жестких условиях претерпевают дальнейшие превращения [54] (Схема 31). Подобные закономерности наблюдаются в реакции 1,1- и 1,2-изомеров перфторметилэтил- и перфтордиэтилбензоциклобутенов с пятифтористой сурьмой 63].
Перфторбензоциклобутен, не имеющий перфторалкильной группы, в присутствии SbF5 димеризуется, давая 1-(2-этилфенил)бензоциклобутен (65). Реакция, по-видимому, протекает путем атаки молекулы субстрата перфторбензоциклобутен-1-ильным катионом с последующим раскрытием четырехчленного цикла в σ-комплексе и улавливанием образующегося катиона анионом фтора [49] (Схема 37).
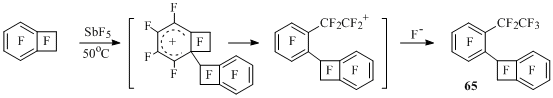
Схема 37
В реакциях перфторированных бензоциклобутена, 1-метил- и 1-этилбензоциклобутенов с HF-SbF5 [64], Br2-SbF5 [49,65] и перфторбензоциклобутена с I2-SbF5 [66] также происходит подобное электрофильное раскрытие четырехчленного цикла субстрата с образованием 2-Х-перфторалкилбензолов (X=H,Br,I). Кроме того, в последней реакции образуется перфтор-орто-ксилол [66], а из перфторированных 1-алкил- и 1,2-диэтил-бензоциклобутенов с I2-SbF5 получаются соответствующие перфтор-орто-диалкилбензолы [66,67] (Схема 38).
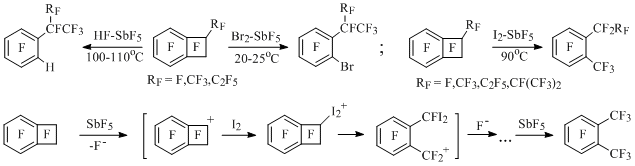
Схема 38
Перфтор-1-фенилбензоциклобутен при нагревании с пятифтористой сурьмой при 170°С после гидролиза реакционной массы возвращается без изменения углеродного скелета в виде 1-гидроксиперфтор-1-фенилбензоциклобутена. В отличие от этого, перфторированные 1-(2-этилфенил)- (65) и 1-(4-этилфенил)бензоциклобутены (66) в аналогичных условиях претерпевают скелетные превращения [31].
Так, из соединения 65 получается перфтор-1,9-диметил-5,6,7,8-тетрагидрофлуорен (67) наряду с производными дифенилметана 68 и 69, причем при увеличении выдержки содержание продукта 67 в смеси возрастает, а соединений 68 и 69 – падает (Схема 39).
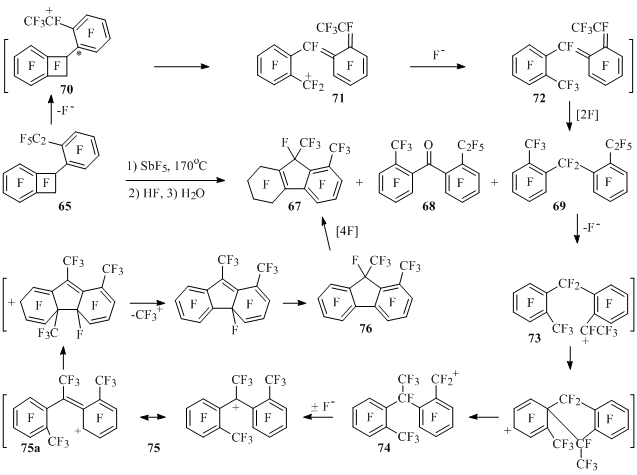
Схема 39
Реакция, по-видимому, протекает следующим образом. Из соединения 65 под действием пятифтористой сурьмы генерируется бензильный катион 70, в котором часть положительного заряда попадает на атом углерода (*), связанный с бензоциклобутенильным фрагментом. В этом катионе, как и в подобных катионах из перфтор-1-алкилбензоциклобутенов, происходит раскрытие четырехчленного цикла с образованием катиона 71. Присоединение к последнему фторид-иона и последующее фторирование соединения 72приводят к продукту 69.
Можно полагать, что дальнейшие превращения соединения 69 протекают по схеме 39, включающей внутримолекулярную перегруппировку катиона 73 в ион 74, который изомеризуется в катион 75. В последнем атака положительно заряженного атома углерода одного ароматического кольца (резонансная структура 75а) на другое кольцо с выбросом CF3+ приводит после изомеризации к перфтор-1,9-диметилфлуорену (76), который фторируется, давая соединение 67.
1-(4-Этилфенил)бензоциклобутен 66 при взаимодействии с пятифтористой сурьмой, как и его изомер 65, вначале дает продукт раскрытия четырехчленного цикла 77. В образующемся из него катионе 78 бензильный атом углерода атакует соседнее шестичленное кольцо, что в конечном итоге приводит к производным антрацена 79 и 80 [31] (Схема 40).
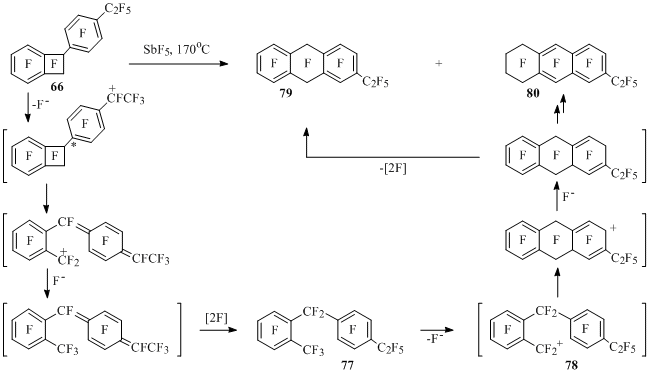
Схема 40
При нагревании эквимолярных количеств перфтор-1-фенил-1,2-диэтилбензоциклобутена и HF в избытке пятифтористой сурьмы наряду с характерным для перфторалкилбензоциклобутенов раскрытием четырехчленного цикла происходит необычная перестройка углеродного скелета субстрата, включающая расширение пентафторбензольного кольца до семичленного цикла [68] (Схема 41).
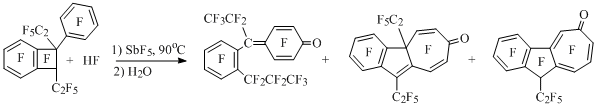
Схема 41
При взаимодействии перфтор-1-фенилиндана (81) с пятифтористой сурьмой образуются флуорен 83, октагидроантрацен 84и соединение 85, являющееся продуктомсокращения шестичленного цикла до пятичленного в октагидроантрацене 84[26] (Схема 42).
В фенилтетралине 82 под действием SbF5 вначале происходит сокращение алициклического фрагмента, приводящее к метилфенилиндену 86 и метилфенилиндану 87, из которого затем образуются соединения 84и 85 [69] (Схема 42). Сокращение кольца в тетралине 82 и соединении 84описывается схемой, аналогичной схеме 27, а образование продуктов 83 и 84 – схемами, подобными схемам 39 и 40.
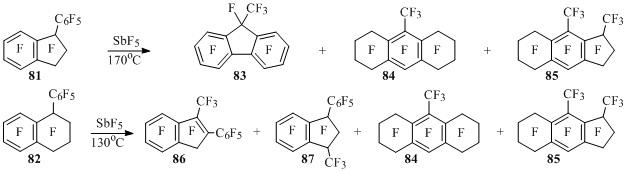
Схема 42
Оказалось, что карбонильные производные перфторбензоциклоалкенов также подвержены карбокатионоидным скелетным превращениям под действием SbF5. При этом из перфториндан-1,3-диона в среде пятифтористой сурьмы получается метилфталид 88[41], а в реакции с HF/SbF5 образуется метиленфталид 89, который при нагревании с SbF5 фторируется до метилфталида 88 [70] (Схема 43).
В перфторбензоциклобутендионе под действием SbF5 происходит расщепление связи С(О)–С(О), приводящее после гидролиза реакционной массы к тетрафторфталевой кислоте [42]. В реакции перфтортетралин-1,4-диона с пятифтористой сурьмой основным продуктом является перфтор-3-этилфталид [42] (Схема 43).
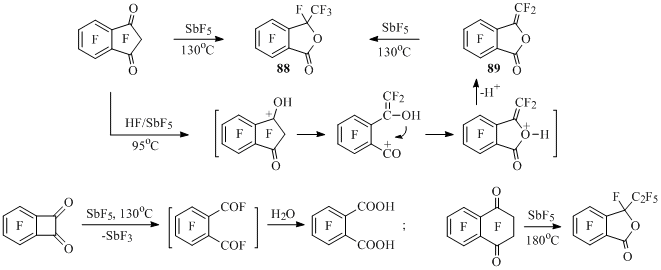
Схема 43
При взаимодействии перфторбензоциклоалкен-1-онов с пятифтористой сурьмой наряду со скелетными превращениями кетонов происходит их диспропорционирование на бензоциклоалкены и бензоциклоалкендионы, которые реагируют далее с образованием смеси продуктов [42] (Схема 44).
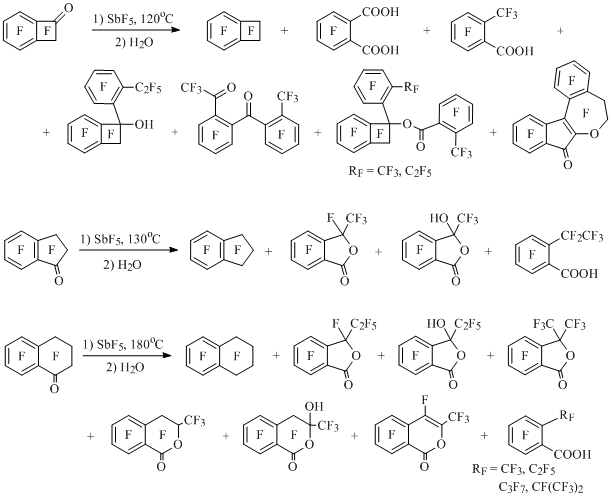
Схема 44
В перфтор-3-этилиндан-1-оне (90) под действием SbF5 при 70°С происходит раскрытие пятичленного цикла, приводящее после гидролиза реакционной массы к кислоте 91. В более жестких условиях образуется раствор солей изохроменильных катионов 92 и 93, при гидролизе которых получаются соответствующие изохромен-1-оны. При увеличении времени проведения реакции катион 92 изомеризуется в термодинамически более стабильный ион 93[43] (Схема 45).
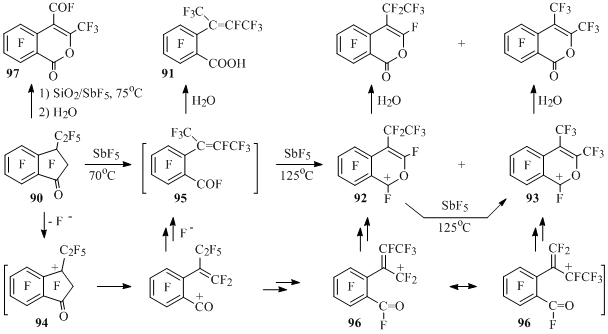
Схема 45
Превращения кетона 90 происходят, по-видимому, с участием катиона 94, в котором раскрывается пятичленный цикл с образованием фторангидрида 95. Внутримолекулярная циклизация катиона 96 с участием одного или другого зарядового центра аллильной системы и последующее перемещение кратной связи внутрь цикла приводят к катионам 92 и 93[43] (Схема 45).
В отличие от инданона 90, перфтор-3,3-диэтилиндан-1-он под действием SbF5 не изменяется даже при 130°C. Однако в более жестких условиях диэтилинданон претерпевает скелетные превращения, механизм раскрытия пятичленного цикла в котором [71] (Схема 46) отличается от механизма раскрытия цикла в этилинданоне 90[43](Схема 45).
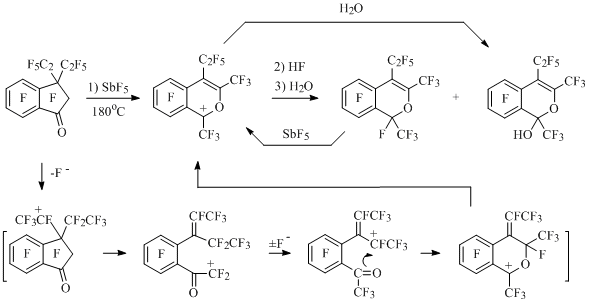
Схема 46
Инданон 90 реагирует с SiO2 в среде SbF5 с образованием после гидролиза реакционной смеси соединения 97 [43] (Схема 45). Это же соединение образуется при взаимодействии перфтор-1-этилиндана (50) с избытком SiO2 в присутствии SbF5 [43].
В реакции перфтор-1-метилиндана (98) с избытком SiO2 в среде SbF5 при 70°C после гидролиза получается 6-(карбоксиметил)-2,3,4,5-тетрафторбензойная кислота, а с недостатком SiO2 – перфтор-3-метилиндан-1-он, из которого в среде SbF5 образуется перфтор-4-метилизохроменильный катион (99) (Схема 47) [72].
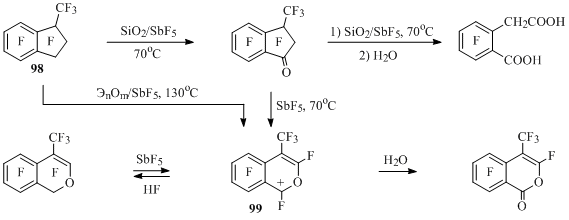
Схема 47
При нагревании метилиндана 98 с SbF5 в стеклянной ампуле при 130°C образуется раствор соли катиона 99, являющегося продуктом взаимодействия соединения 98 с пятифтористой сурьмой и стеклом как источником неорганических оксидов (ЭnOm). При гидролизе реакционной смеси получается перфтор-4-метилизохромен-1-он, а при гашении безводным HF – перфторперфтор-4-метил-1Н-изохромен [72,73] (Схема 47).
Из этилфенилбензоциклобутенона 100 и пятифтористой сурьмы при 70°С образуется раствор соли катиона 101, дающий при гидролизе фталид 102 [74] (Схема 48).
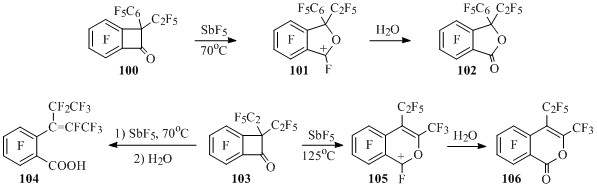
Схема 48
В диэтилбензоциклобутеноне 103под действием SbF5 при 70°С происходит раскрытие четырехчленного цикла, приводящее после гидролиза реакционной массы к кислоте 104. В более жестких условиях образуется раствор соли изохроменильного катиона 105, при гидролизе которого получается изохроменон 106 [74] (Схема 48).
Таким образом, изучение электрофильных реакций, карбокатионов и катионоидных скелетных превращений полифтораренов и их производных является плодотворным направлением исследований, в ходе которых найдены закономерности фундаментального характера, расширяющие наши знания о химическом поведении ароматических соединений. Рассмотренные реакции оказались перспективными и в синтетическом отношении. С их помощью получены труднодоступные полифторированные производные циклогексадиенов, циклогексадиенонов, флуоренов, а также перфторированные орто-диалкил- и орто-галогеналкилбензолы, алкилфталиды, алкилизохроменоны, алкил- и арилбензоциклоалкены и их кетопроизводные. Можно полагать, что дальнейшее исследование катионоидных реакций полифтораренов приведет к получению новой информации о механизме этих реакций, разработке новых синтетических методов получения различных производных полифтораренов.
Список литературы
1.Finger G.C., Reed F.H., Oesterling R.E. // J. Amer. Chem. Soc. 1951. V. 73. N 1. P. 152-153.
2.Nield E., Stephens R., Tatlow J.C. // J. Chem. Soc. 1959. N 1. P. 166-167.
3.Pummer W.J., Wall L.A. // J. Res. NBS. 1959. V. 63A. P. 167-169; Chem. Abstr.1960.V.54. 10906h.
4.Якобсон Г.Г., Штейнгарц В.Д., Ворожцов Н.Н. // Журн. Всесоюз. хим. о-ва им.Д.И.Менделеева 1964. Т. 9.N6. С. 702-704.
5.Штейнгарц В.Д., Якобсон Г.Г., Ворожцов Н.Н. // Докл. АНСССР. 1966. Т. 170.N6. С.1348-1351.
6.Штейнгарц В.Д., Якобсон Г.Г.// Журн. Всесоюз. хим. о-ва им. Д.И.Менделеева 1970.Т. 15.N1. С. 72-80.
7.Штейнгарц В.Д., Кобрина Л.С., Билькис И.И., Стариченко В.Ф. // Химияполифтораренов: механизм реакций, интермедиаты. Новосибирск: Изд-во «Наука»Сиб. Отд. 1991. 272 с.
8.Штейнгарц В.Д. // Успехи химии. 1981. Т. 50.N8. С. 1407-1436.
9.Штейнгарц В.Д. // Журн. орган. химии. 1975. Т. 11. Вып. 2. С. 461.
10. Штейнгарц В.Д., Добронравов П.Н. // Журн. орган. химии. 1976. Т. 12. Вып. 9. С. 2005-2012.
11. Добронравов П.Н., ШтейнгарцВ.Д. // Журн. орган. химии. 1977. Т. 13. Вып. 8. С. 1679-1684.
12.ShteingartsV.D.,PozdnyakovichYu.V.,YakobsonG.G. //Chem.Commun. 1969.N21.P.1264-1265.
13. Добронравов П.Н., Штейнгарц В.Д. // Журн. орган. химии. 1981. Т. 17. Вып. 10. С.2245-2246.
14. Карпов В.М., Платонов В.Е., Якобсон Г.Г. // Журн. орган. химии. 1974. Т. 10. Вып. 3.С. 663-664.
15. Карпов В.М., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР. Сер. хим. 1976.N11. С.2647-2648.
16. Karpov V.M., Platonov V.E., Yakobson G.G. // Tetrahedron.1978.V. 34.N21.P. 3215-3218.
17. Карпов В.М., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР. Сер. хим. 1979.N9.-С.2082-2087.
18. Карпов В.М., Платонов В.Е., Щеголева Л.Н. // Журн. орган. химии. 1998. Т. 34. Вып.11. С. 1732-1737.
19. Карпов В.М., Платонов В.Е., Чуйков И.П., Щеголева Л.Н. // Журн. орган. химии. 1999.Т. 35. Вып.1. С. 87-91.
20. Дьюар М. // Теория молекулярных орбиталей в органической химии. М.:Мир. 1972.592с.
21. Breslow R. // Chem. Eng. News. 1965. V. 43. N 26. P. 90-99.
22. Breslow R. // Pure Appl. Chem. 1971. V. 28. N 2-3. P. 111-130.
23. Breslow R. // Acc. Chem. Res. 1973. V. 6. N 12. P. 393-398.
24. Щеголева Л.Н., Карпов В.М., Платонов В.Е. // Журн. орган. химии. 2002. Т. 38. Вып. 7.С. 1037-1042.
25. Карпов В.М., Платонов В.Е. // Журн. орган. химии. 2001. Т. 37. Вып.7. С. 1033-1039.
26.KarpovV.M.,MezhenkovaT.V.,PlatonovV.E.,SinyakovV.R. //J.FluorineChem. 2001.V. 107.N1.P. 53-57.
27. Позднякович Ю.В., Штейнгарц В.Д. // Журн. орган. химии.1978.Т. 14.Вып.3.С. 603-609.
28. Olah G.A., Comisarow M.B. // J. Amer. Chem. Soc. 1967. V. 89. N 4. P. 1027-1028.
29. Pozdnyakovich Yu.V. Shteingarts V.D. // J. Fluorine Chem. 1974. V. 4. N 3. P. 283-296.
30. Pozdnyakovich Yu.V. Shteingarts V.D. // J. Fluorine Chem. 1974. V. 4. N 3. P. 297-316.
31. Karpov V.M., Mezhenkova T.V., Platonov V.E., Sinyakov V.R. // J. Fluorine Chem. 2002.V. 117.N1.P. 73-81.
32. Карпов В.М., Платонов В.Е. // Журн. орган. химии. 1994. Т. 30. Вып.5. С. 789.
33. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР. Сер. хим.1985.N10. С. 2315-2323.
34.KarpovV.M.,MezhenkovaT.V.,PlatonovV.E.,YakobsonG.G. //J.FluorineChem. 1985.V. 28.N1.P. 121-137.
35. Карпов В.М., Меженкова Т.В., Платонов В.Е., Синяков В.Р., Щеголева Л.Н. // Журн.орган. химии. 2002.Т. 38. Вып. 8.С. 1210-1217.
36. Синяков В.Р., Меженкова Т.В., Карпов В.М., Платонов В.Е. // Журн. орган. химии.2007. Т. 43. Вып. 12. С. 1678-1686.
37. Синяков В.Р., Меженкова Т.В., Карпов В.М., Платонов В.Е., Рыбалова Т.В., ГатиловЮ.В. // Журн. орган. химии. 2003. Т. 39. Вып. 6. С. 886-891.
38. Синяков В.Р., Меженкова Т.В., Карпов В.М., Платонов В.Е., Рыбалова Т.В., ГатиловЮ.В. // Журн. орган. химии.2006.Т. 42.Вып. 1.С. 85-93.
39. Pozdnyakovich Yu.V. Shteingarts V.D. // J. Fluorine Chem. 1974. V. 4.N3.P. 317-326.
40. Карпов В.М., Пантелеев И.В., Платонов В.Е. // Журн. орган. химии.1991.Т. 27.Вып.10.С. 2183-2191.
41. Zonov Ya.V., Karpov V.M., Platonov V.E. // J. Fluorine Chem. 2005. V. 126.N4.P. 437-443.
42. Зонов Я.В., Карпов В.М., Платонов В.Е., Гатилов Ю.В. // Журн. орган. химии.2008.Т.44.Вып. 2.С. 212-226.
43. Zonov Ya.V., Karpov V.M., Platonov V.E. // J. Fluorine Chem. 2007. V. 128. N 9. P. 1065-1073.
44. Zonov Ya.V., Karpov V.M., PlatonovV.E. // J. Fluorine Chem. 2007. V. 128.N9.P. 1058-1064.
45. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г. // Журн. орган. химии.1984. Т. 20. Вып. 6.С. 1341-1342.
46. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР.Сер. хим.1987.N6. С. 1361-1368.
47. Позднякович Ю.В., Бардин В.В, Штарк А.А, Штейнгарц В.Д. // Журн. орган. химии.1979.Т. 15.Вып. 3.С. 656.
48. Bardin V.V., Furin G.G., Yakobson G.G. // J. Fluorine Chem. 1979. V. 14. N 6. P. 455-466
49. Karpov V.M., Mezhenkova T.V., Platonov V.E., Yakobson G.G. // Bull. Soc. Chim.Fr.1986.N6.P. 980-985.
50. Карпов В.М., Меженкова Т.В., Платонов В.Е. // Журн. орган. химии.1997.Т. 33.Вып.5.С. 755-761.
51. Karpov V.M., Mezhenkova T.V., Platonov V.E. // J. Fluorine Chem. 1996. V. 77. N 1. P.101-103.
52. Garcia R., Riera J., Carilla J., Julia L., Molins E. // J. Org. Chem. 1992. V. 57. N 21. P. 5712-5719.
53. Zorkendorfer E., Boberg F. // J. Label. Comp. 1972.V. 8.N4.P. 567-574.
54. Карпов В.М., Меженкова Т.В., Платонов В.Е. // Изв. АН СССР. Сер. хим. 1992.N6. С.1419-1423.
55. Карпов В.М., Меженкова Т.В., Платонов В.Е. // Изв. АН СССР. Сер. хим. 1990.N3. С.645-652.
56. Платонов В.Е., Дворникова К.В. // Изв. АН СССР. Сер. хим. 1989.N12. С. 2854-2857.
57. Карпов В.М., Платонов В.Е. // Изв. АН СССР. Сер. хим. 1998.N8. С. 1666-1667.
58. Чепик С.Д., Петров В.А., Галахов М.В., Беленький Г.Г., Мысов Е.И., Герман Л.С. //Изв. АНСССР.Сер.хим. 1990. N 8.С. 1844-1851.
59. Petrov V.A., Krespan C.G., Smart B.E. // J. Fluorine Chem. 1996. V. 77.N2.P. 139-142.
60. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР. Сер. хим.1980.N5. С. 1212-1213.
61.KarpovV.M.,MezhenkovaT.V.,PlatonovV.E.,YakobsonG.G. //J.FluorineChem. 1985.V. 28. N 1. P. 115-120.
62. WhitlockH.W., Fuch Ph. // Tetrahedron Lett. 1968. N 12. P. 1453-1456.
63. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г. // Изв. АН СССР. Сер. хим.1990.N5. С. 1114-1120.
64. Карпов В.М., Меженкова Т.В., Платонов В.Е., Щеголева Л.Н. // Изв. АН СССР. Сер.хим. 1991.N11. С. 2618-2622.
65.KarpovV.M.,MezhenkovaT.V.,PlatonovV.E. //J.FluorineChem. 1996.V. 77. N 2. P.133-137.
66. Karpov V.M., Mezhenkova T.V., Platonov V.E. // Mendeleev Commun.1997.N2.P. 71-72.
67. Т.В.Меженкова, В.М.Карпов, В.Е.Платонов. // Журн. орган. химии. 2010. Т.46. Вып. 9.С.1414-1416.
68.MezhenkovaT.V.,SinyakovV.R.,KarpovV.M.,PlatonovV.E.,RybalovaT.V.,GatilovYu.V. //J.FluorineChem. 2008.V. 129. N 1. P. 64-67.
69.Sinyakov V.R., Mezhenkova T.V., Karpov V.M., Platonov V.E. // J. Fluorine Chem. 2004.V. 125. N 1. P. 49-53.
70. Zonov Ya.V., Karpov V.M., Platonov V.E., Rybalova T.V., Gatilov Yu. V. // J. FluorineChem. 2006. V. 127.N12.P. 1574-1583.
71. Зонов Я.В., Карпов В.М., Платонов В.Е. // Журн. орган. химии. 2011. Т. 47.N2. С. 217-222.
72. Зонов Я.В., Меженкова Т.В., Карпов В.М., Платонов В.Е. // Журн. орган. химии. 2008.Т. 44. Вып 11. С. 1675-1679.
73. Карпов В.М., Меженкова Т.В., Платонов В.Е., Якобсон Г.Г.// Изв. АН СССР. Сер. хим.1991.N3. С. 745-746.
74.ZonovYa.V.,MezhenkovaT.V.,KarpovV.M.,PlatonovV.E. //J.FluorineChem. 2008.V.129. N 12. P. 1206-1208.
Материал рекомендован к публикации членом редколлегии В.Е. Платоновым
Fluorine Notes, 2011, 79, 1-2
