Received: июль, 2011
Fluorine Notes, 2011, 78, 3-4
Влияние заместителей в аллиловом спирте на реакцию с полифторалкилхлорсульфитами
А.И. Рахимов1, Г.И.Никишшин2, А.В. Мирошниченко1, Зыонг Фыонг Тхао До1
1Волгоградский государственный технический университет, 400131, Волгоград, пр. Ленина, 28
e-mail: organic@vstu.ru
2 Институт органической
химии имени Н.Д. Зелинского РАН, 119991, г. Москва, Ленинский проспект, 47, e-mail: nika@ioc.ac.ru
Аннотация. Установлено, что при получении простого эфира введение фенильного заместителя или атомов хлора в аллиловый спирт влияет на его реакцию с полифторалкилхлорсульфитами: реакция фенилзамещенного (коричного) спирта идет в присутствии карбоната калия (аналогично аллиловому спирту), а для трихлораллилового спирта необходим катализ N,N-диметилформамидом.
Ключевые слова: Аллиловый спирт, трихлораллиловый спирт, коричный спирт, аллиловые эфиры, полифторированный спирт, N,N-диметилформамид, полифторалкилхлорсульфит.
Известно, что предельные одноатомные и жирноароматические спирты реагируют с полифторалкилхлорсульфитами (ПФАХС) в присутствии катализатора N,N-диметилформамида (ДМФА) с образованием простых эфиров [1-6]. Однако, в случае реакции полифторалкилхлорсульфита с коричным спиртом (катализ ДМФА) наблюдается образование полифторированного спирта и циннамилхлорида (реакция протекает аналогично аллиловому спирту [7,8]). Возможно, гидролиз хлорсульфита идет по схеме:
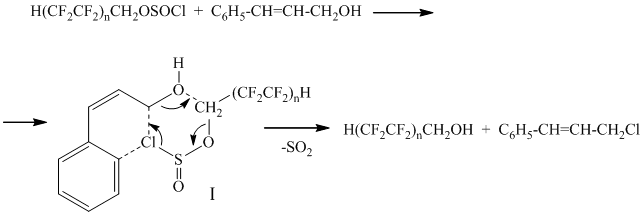
n = 2, 3.
Атом хлора хлорсульфитной группы атакует углеродный атом метиленовой группы коричного спирта с одновременным нуклеофильным замещением хлорсульфитной группы на гидроксильную через переходное состояние, распад которого сопровождается выделением диоксида серы.
В качестве побочного продукта образуется коричный эфир полифторированного спирта, причем, при использовании более длинноцепочного хлорсульфита (n=3) выход эфира увеличивается до 20%. Это, видимо, связано с возрастанием стерического фактора с увеличением объема полифторалкильного заместителя, что препятствует образованию переходного состояния, ведущего к полифторированному спирту.
Кроме того, из реакционной массы был выделен олигомер, представляющий собой вязкую стеклообразную массу светло-коричневого цвета. Олигомер не растворяется в воде, при нагревании растворяется в этаноле и диэтиловом эфире. Очевидно, образующийся в условиях реакции 1-фенил-3-хлорпропен-1 легко олигомеризуется.
Применение карбоната калия, способствующего ориентации реакционных центров взаимодействующих молекул ПФАХС и коричного спирта, позволяет изменить направление реакции:

В результате реакции полифторалкилхлорсульфитов с коричным спиртом в присутствии карбоната калия получены эфиры с выходом 32 – 43% (табл. 1).
Таблица 1. Выход полифторированных эфиров коричного спирта
|
# п/п |
ПФАХС |
Основный реагент |
Выход эфира, % |
|
1 |
n = 3 |
ДМФА |
20.0 |
|
2 |
n = 2 |
K2CO3 |
42.7 |
|
3 |
n = 3 |
K2CO3 |
32.5 |
Реакцию полифторалкилхлорсульфитов с коричным спиртом проводили в два этапа. На первом этапе при –10÷ –5 °С смешивали реагенты (коричный спирт, карбонат калия и полифторалкилхлорсульфит) в хлороформе, при этом наблюдалось появление окраски – раствор становился розовато-оранжевого цвета. Далее, на втором этапе реакционную массу нагревали до температуры 30-40 °С и выдерживали в течение 6 часов. При этом окраска исчезала. Затем осадок хлорида калия и бикарбоната калия отфильтровывали, растворитель удаляли, остаток перегоняли в вакууме.
Появление окраски на первом этапе, вероятно связано с образованием комплекса полифторалкилхлорсульфит – коричный спирт – карбонат калия, устойчивого при низких температурах. На это указывают УФ-спектры окрашенного раствора: появляется пик в видимой области при 490 нм, который исчезает при нагревании с обесцвечиванием раствора. Полученные эфиры – прозрачные высококипящие жидкости, густеющие при стоянии и приобретающие красно-коричневую окраску, в ИК- и УФ-спектрах появляются полосы поглощения, характерные для хинонов [9].
Реакция полифторалкилхлорсульфита (изучали на примере 1,1,5-тригидроперфторпентилхлорсульфита) с трихлораллиловым спиртом в присутствии карбоната калия в условиях, идентичных для коричного спирта, идет с низким выходом эфира (выход 9.2% ). В этом случае образуется сложная смесь продуктов дегидрохлорирования и гидролиза благодаря взаимодействию карбоната калия с трихлораллиловым спиртом, обладающим высокой кислотностью из-за наличия атомов хлора.
В связи с этим был использован катализ ДМФА, как и в случае реакции предельных одноатомных и жирноароматических спиртов с полифторалкилхлорсульфитами [1-5]:
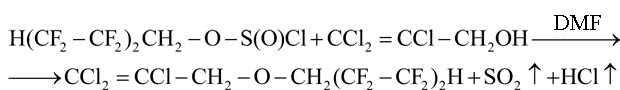
Трихлораллиловый спирт вводили в реакцию в виде ассоциатов с ДМФА (соотношение 1:0.05 моль) в растворе хлороформа. Ассоциаты образуются за счет водородных связей между атомом О(2) в молекуле ДМФА и подвижными атомами водорода Н(1) и Н(2) в молекуле спирта:
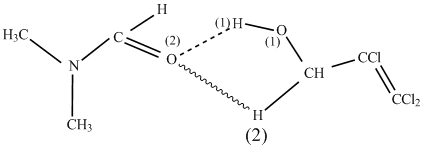
В ассоциатах происходит поляризация связи Н(1)- О(1) (связь растягивается) и протон становится более
подвижным.
Реакцию проводили в две стадии. На первой стадии ПФАХС дозировали в полученный раствор
при –10°С. Наиболее вероятно как показано в работе [6], в этом случае происходит образование комплекса
шестичленной структуры, в котором участвуют атомы О(1)-С(3) и Н(1)-Cl. Высокая нуклеофильность
атома хлора и значительный положительный заряд на протоне НО-группы спирта благоприятствуют образованию
такого комплекса:
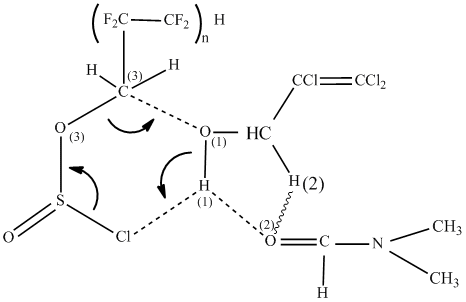
На второй стадии проводили разложение комплекса нагреванием реакционной смеси до температуры 25-30 ºС и выдерживанием ее в течение 4-6 часов. На этой стадии происходит перенос протона спирта к полярному атому хлора и одновременный разрыв связей С(3)-O(3), S-Cl с выделением молекул SO2 и HCl с регенерацией молекулы ДМФА и образованием молекулы простого эфира:
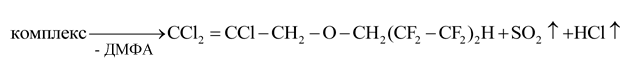
После отгонки растворителя (хлороформ) продукт перегоняли. Выход трихлораллилового эфира 1,1,5-тригидроперфторпентанола составил 53.0% (табл. 2).
Таблица 2. Выход эфиров 1,1,5- тригидроперфторпентанола
|
# |
Спирт и основный реагент |
Выход эфира, % |
|
|
1 |
аллиловый спирт, K2CO3 |
40.4 |
|
|
2 |
аллиловый спирт, ДМФА |
следы |
|
|
3 |
трихлораллиловый спирт, K2CO3 |
следы |
|
|
4 |
трихлораллилиловый спирт, ДМФА |
53.0 |
|
Строение полученных простых непредельных эфиров полифторированных спиртов исследовалось методами ИК- и ПМР- спектроскопии.
В ИК- спектрах простых полифторированных эфиров для связей С-О-С характерна сильная узкая полоса при 1150- 1060 см–1, обусловленная ассиметричными валентными колебаниями. В области 1250–1050 см–1 проявляется также поглощение C-F группы в виде сильной широкой полосы, от полосы поглощения эфирной С-О-С группы она отличается шириной, однако иногда происходит их наложение [9 - 12].
Метиленовые группы проявляются в области 2880 – 2980 см–1 в виде слабых и средних полос, полоса поглощения связи CF2-H из-за наличия электроотрицательных атомов фтора лежит в области более высоких волновых чисел – 2995 – 3050 см–1, для нее характерна очень слабая интенсивность.
В аллиловых полифторированных эфирах пик поглощения изолированной двойной связи находится в интервале 1680-1620 см–1. Для синтезированных аллиловых полифторированных эфиров полосы поглощения наблюдаются при 1677-1686 см–1, что связано с электроноакцепторным индуктивным влиянием перфторированной углеродной цепочки. В случае трихораллилового полифторированного эфира, валентные колебания двойной связи (влияние атомов хлора) наблюдаются при 1621 см–1. Кроме того, при 700-800 см–1 проявляется сильная полоса, обусловленная колебаниями связи С-Сl.
В полифторированных эфирах коричного спирта, пик поглощения двойной связи, сопряженной с фенилом наблюдается при 1625 см–1. В интервале 1625 - 1575 см–1 наблюдаются колебания ароматического кольца. В области 770-730 см–1 и 710-690 см–1 проявляются сильные полосы, обусловленные деформационными колебаниями С-Н в монозамещенном ароматическом кольце. В области 3000 см–1 проявляются валентные колебания связей С-Н, имеющие среднюю интенсивность. Обычно они представляют собой группу полос. При наличии в молекуле, кроме ароматического кольца алифатической цепи, полосы поглощения ароматических связей С-Н появляются как плечи на основной алифатической полосе νC-Н.
В ПМР-спектрах простых полифторированных эфиров присутствуют сигналы протонов HCF2CF2-группы в виде триплета триплетов в области 5.8-6.2 м.д. Расщепление в триплете обусловлено спин – спиновым взаимодействием протона с атомами фтора группы HCF2 (JHCF2=51.6-51.9 Гц) и более слабым взаимодействием с атомами фтора соседней дифторметиленой группы (JHCF2CF2=5.1-5.4 Гц), что соответствует литературным данным для HCF2CF2-группы [12]. α-Метиленовая группа в H(CF2CF2)nCH2 -группировке проявляется в виде триплета со значениями JHF, равными 13.2-14.1 Гц, что объясняется взаимодействием протонов с атомами фтора.
В ПМР-спектрах синтезированных аллиловых эфиров, аллильная группа проявляется в виде характерного дублета О-СН2- в области 4.38 - 4.47 м.д. и мультиплета CН2-протонов с δ 5.265 м.д. и 5.259 м.д. и СН-протона около 5.8 м.д.
Спектр ПМР коричных эфиров полифторированных спиртов характеризуется, кроме того, наличием мультиплета в области 7.0 – 7.3 м.д., принадлежащего 5 протонам бензольного кольца.
Спектр ПМР трихлораллилового эфира полифторированных спиртов достаточно простой. Здесь, кроме сигналов, характеризующих полифторалкильный фрагмент, наблюдается только один синглет =СCl-СН2- группы.
Экспериментальная часть
ИК- спектры жидких веществ снимали на приборе "Spekord – M82" в тонком слое (жидкая пленка). ПМР – спектры веществ снимали на приборе Mercury-300 (Varian), рабочая частота 300 МГц, внутренний стандарт тетраметилсилан, растворитель – четыреххлористый углерод. УФ-спектры снимали в растворе хлороформа на приборе спектрофотометр СФ-2000 ОКБ "Спектр".
1. Синтез 3-(2,2,3,3-тетрафтор)пропокси-1-пропена (СН2=СН-СН2-O-CH2CF2CF2 H)
В трехгорлый реактор, снабженный термометром, обратным холодильником и мешалкой, поместили раствор в 30 мл хлороформа 1.49 г (0.026 моль) аллилового спирта в смеси с 3.54 г (0.026 моль) K2CO3, охладили до –15°С и дозировали при этой температуре раствор 5.5 г (0.026 моль) 1,1,3-тригидроперфторпропилхлорсульфита в 10 мл хлороформа. Затем нагрели реакционную смесь до 30°С и при перемешивании выдерживали 6 ч. После отделения от осадка и отгонки растворителя и непрореагировавшего спирта продукт перегоняли в вакууме. Получили 2.92 г (66.2 %) 3-(2,2,3,3-тетрафтор)пропокси-1-пропена, т.кип. 95-98 °С/15 мм рт. ст., nD20 1.3660, d204 1.4286. ИК-спектр, ν, см -1: 529ср, 674ср, 760с, 794сл, 880с, 931с, 983с, 1043ср, 1077сл, 1108сл, 1158(νС-О-С), 1206(νCF2), 1326с, 1389ср, 1429с, 1489с, 1583сл, 1677(С=С), 2920сл, 2989, 3031ср (CH2, CH), 3126(=C-H)
2. Синтез 3-(2,2,3,3,4,4,5,5-октафтор)пентокси-1-пропена (СН2=СН-СН2-O-CH2(CF2CF2)2H)
Получение и выделение проводили аналогично п. 1. Выход 40.4%, т.кип. 98-100 °С/ 15 мм рт. ст., nD20 1.3635, d20441.4418. Найдено, %: F 54.29. C8H7F8O. Вычислено, %: F 55.88. ИК-спектр, ν, см –1: 527ср, 662ср, 759с, 801сл, 886с, 945с, 996с, 1038ср, 1080сл, 1114сл, 1165(νС-О-С), 1207(νCF2), 1317с, 1385ср, 1435с, 1486с, 1554сл, 1682(С=С), 2927сл, 2994, 3042ср(CH2,CH), 3137(=C-H).
ПМР-спектр, δ, м.д. (КССВ, J, Гц): 6.005 тт (51.9, 5.4) (2Н, HCF2); 5.831 мультиплет (1Н, =СН); 5.265 мультиплет (2Н, СH2=С); 4.471 д (3.3) (2Н, =С-СН2-O); 4.339 т (14.1) (1Н, O-CH2CF2).
3. Синтез 3-(2,2,3,3,4,4,5,5,6,6,7,7-додекафтор) гептокси-1-пропена (СН2=СН-СН2-O-CH2(CF2CF2)3H)
Получение и выделение проводили аналогично п. 1. Выход 86.9%, т.кип. 90 ºС/ 6 мм рт. ст., nD201.3560, d204 1.4816. Найдено, %: F 60.77. C10H7F12O. Вычислено, %: F 61.29. ИК-спектр, ν, см–1: 523ср, 700 с, 751ср, 880с, 931с, 1000 с, 1069с, 1094сл, 1129сл, 1189 (νС-О-С), 1249 (νCF2), 1334ср, 1446с, 1497с, 1574сл, 1686 (С=С), 2886сл, 2997, 3057ср (CH2, CH), 3143(=C-H).
ПМР-спектр, δ, м.д. (КССВ, J, Гц): 6.017 тт (51.6, 5.1) (2Н, HCF2); 5.814 мультиплет (1Н, =СН); 5.259 мультиплет (2Н, СH2=С); 4.382 д (3.3) (2Н, =С-СН2-O); 3.931 т (13.2) (1Н, O-CH2CF2).
4. Синтез 3-(2,2,3,3,4,4,5,5-октафтор)пентокси-1-фенил-1-пропена (С6H5-СH=СН-СН2-OCH2(CF2CF2)2H)
Получение и выделение проводили аналогично п. 1. Выход 43%, т.кип. 55-57 ºС/ 1 мм рт. ст., nD20 1.4375, d2041.4587. ИК-спектр, ν, см–1: 537с, 623ср, 691с, 739с, 803с, 889с, 962ср, 983сл, 1120 (νС-О-С), 1163 (νCF2), 1283с, 1362ср, 1394ср, 1446с, 1489с; 1621, 1677, 1729 (С=С, Ph), 1823ср, 1883ср, 1951ср, 2869ср, 2929 3023, 3057, 3091 (=C-H).
ПМР-спектр, δ, м.д. (КССВ, J, Гц): 7.227 мультиплет (5Н, С6H5); 6.483 д (15.6) (1Н, Ph-СH=); 6.126 кв (1Н, =СН-С-О); 5.930 тт (51.9, 5.4) (1Н, HCF2); 4.137 д (6.6) (2Н, =С-СН2-O) мультиплет (1Н, =СН); 5.259 мультиплет (2Н, СH2=С); 4.382 д (3.3) (2Н, =С-СН2-O); 3.931 т (13.2) (2Н, O-CH2CF2).
5. Синтез 3-(2,2,3,3,4,4,5,5,6,6,7,7-додекафтор)гептокси-1-фенил-1-пропена (С6H5-СH=СН-СН2-OCH2(CF2CF2)3H)
Получение и выделение проводили аналогично п. 1. Выход 32.5%, т.кип. 70-73 ºС/ 1 мм рт. ст., nD20 1.3950, d2041.4821. ИК-спектр, ν, см–1: 527с, 611сл, 679с, 734с, 818с, 903ср, 947с, 1000с, 1035ср, 1068сл, 1169 (νС-О-С), 1237 (νCF2), 1393с, 1435с, 1486с, 1528с, 1570сл, 1634, 1718, 1755 (С=С, Ph), 1845ср, 1917ср, 1988ср, 2910ср, 2961, 3054, 3087, 3121(=C-H).
6. Синтез 3-(2,2,3,3,4,4,5,5-октафтор)пентокси-1,1,2-трихлор-1-пропена (СCl2=СCl-СН2-O-CH2(CF2CF2)2H)
4.1 г (0.025 моль) 1,1,2-трихлор-1-пропен-3-она (трихлораллилового спирта) смешали с 0.1 мл (0.001 моль) N,N-диметилформамида в 20 мл хлороформа, охладили до -10°С и при перемешивании, поддерживая температуру, дозировали раствор 7.98 г (0.025 моль) 1,1,5-тригидроперфторпентилхлорсульфита в 10 мл хлороформа. Затем температуру реакционной смеси повысили до 30°С и выдерживали 6 ч, отдувая выделяющийся хлористый водород и диоксид серы осушенным воздухом. Растворитель отогнали, продукт перегоняли в вакууме. Получили 5.05 г (53%) эфира, т.кип. 102-105ºС/1 мм рт. ст., nD201.4180, d204 1.6548. ИК-спектр, ν, см–1: 506 с, 621сл, 674с, 771с (С-Сl), 912с, 974с, 1035ср, 1088сл, 1150сш (νС-О-С), 1212с (νCF2), 1300с, 1379с, 1424с, 1468с, 1621 (С=С), 2906сл, 2976 (ν CH2), 3008сл (CHF2).
ПМР-спектр, δ, м.д. (КССВ, J, Гц): 6.002 тт (51.9, 5.1) (1Н, HCF2); 4.822 с (2Н, =СCl-СН2-O); 4.299 т (13.2) (2Н, O-CH2-CF2).
Библиографический список
1. Рахимов, А. И. Новый метод синтеза полифторированных простых эфиров // Журнал органической химии
/ А. И. Рахимов, А. В. Налесная, О. В. Вострикова. - 2004. - Т. 74. , вып. 4. - С. 967.
2. Рахимов, А. И. Реакция полифторалкилхлорсульфитов с бензиловыми спиртами // Журнал общей химии
/ А. И. Рахимов, Р. В. Фисечко. - 2007. - Т. 77, вып. 10. - C. 1750-1751.
3. Рахимов, А.
И. Новый метод синтеза полифторалкилциклогексиловых эфиров // Журнал общей химии / А. И. Рахимов,
Р. В. Фисечко. - 2008. - Т. 78, вып. 2. - С.338.
4. Рахимов, А. И. Особенности катализа реакции
полифторалкил-хлорсульфитов с предельными одноатомными спиртами // Журнал общей химии / А. И.
Рахимов, А. В. Налесная, Р. В. Фисечко. - 2008. - Т. 78, вып. 11. - C. 1842-1848.
5. Пат.
2346926 Российская Федерация, МПК C 07 C43/192, C 07 C43/12, C 07 C43/225, C 07C 43/174. Способ
получения простых полифторалкиловых эфиров / А.И. Рахимов, А.В. Налесная, Р.В. Фисечко; ГОУ ВПО
ВолгГТУ. - 2009.
6. Рахимов, А. И. Синтез полифторалкилхлорсульфитов и новые реакции с их
участием // Журнал общей химии - 2010. - Т. 80, вып. 8. - C. 1622-1641.
7. Рахимов, А.И.
Синтез аллиловых эфиров полифторированных спиртов / А.И. Рахимов, А.В. Мирошниченко, Зыонг Фыонг
Тхао До // Известия ВолгГТУ. Серия «Химия и технология элементоорганических мономеров и полимерных
материалов». Вып. 7 : межвуз. сб. науч. ст. / ВолгГТУ. - Волгоград, 2010. - № 2. - C. 47-49.
8. До, Зыонг Фыонг Тхао. Синтез аллиловых эфиров полифторированных спиртов // До Зыонг Фыонг
Тхао, А. И. Рахимов, А. В. Мирошниченко // Актуальные проблемы органической химии: сб.
матер. всеросийской конф. с элементами науч. школы для молодежи, 6-8 окт. 2010 г. / ГОУ ВПО «Казанский
гос. технол. ун-т». – Казань: КГТУ, 2010. - С. 20.
9. Беллами, Л. Инфракрасные спектры сложных
молекул. - М.: ИЛ, 1963. 590 с.
10. Отто, М. Современные методы аналитической
химии. - М.: Техносфера, 2006. – 416 с.
11. Казицына, Л. А. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии
в органической химии : учеб. пособие для вузов / Л. А. Казицына, Н. Б. Куплетская. – М., Высш.
школа, 1971. – 264с.
12. Ионин Б.И., Ершов Б.А. ЯМР-спектроскопия в органической химии. -
Л.: Химия, 1967. - 326 с.
Материал рекомендован к публикации членом редколлегии А.И. Рахимовым
Fluorine Notes, 2011, 78, 3-4
